Furano
| Furano | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Molecola di furano |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificazione | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sinonimi |
Furfuranne |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.003.390 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CE | 203-727-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 8029 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 35559 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SORRISI |
C1 = COC = C1 , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C4H4O / c1-2-4-5-3-1 / h1-4H Std. InChI: InChI = 1S / C4H4O / c1-2-4-5-3-1 / h1-4H Std. InChIKey: YLQBMQCUIZJEEH-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | liquido limpido incolore che diventa gradualmente marrone con un odore caratteristico. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà chimiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formula bruta |
C 4 H 4 O [Isomeri] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa molare | 68,074 ± 0,0038 g / mol C 70,57%, H 5,92%, O 23,5%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Momento dipolare | 0,66 ± 0,01 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diametro molecolare | 0,502 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusione | −85,6 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° bollitura | 31,5 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilità | 10 g · l -1 (acqua, 20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametro di solubilità δ |
19,2 MPa 1/2 ( 25 ° C ); 18,6 J 1/2 · cm -3/2 ( 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa volumica |
0,9644 g · cm -3 ( 0 ° C )
equazione:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura di autoaccensione | 390 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto d'infiammabilità | −35 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limiti di esplosività in aria | 2,3 - 14,3 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressione del vapore saturo |
0,658 bar a 20 ° C 1,0 bar a 30 ° C 1,907 bar a 50 ° C 3,105 bar a 65 ° C equazione:
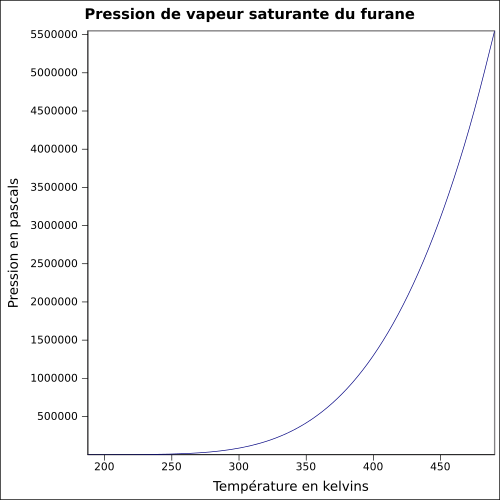
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto critico | 55,0 bar , 217,05 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochimica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
equazione:
equazione:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà elettroniche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re energia di ionizzazione | 8,883 ± 0,003 eV (gas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà ottiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indice di rifrazione | 1.4187 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauzioni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Pericolo H224, H302, H315, H332, H341, H350, H373, H412, EUH019, P201, P210, P261, P273, P281, P311, H224 : Liquido e vapori estremamente infiammabili H302 : Nocivo se ingerito H315 : Provoca irritazione cutanea H332 : Nocivo per inalazione H341 : Sospettato di provocare difetti genetici (indicare la via di esposizione se è dimostrato in modo conclusivo che nessun'altra via di esposizione porta allo stesso pericolo ) H350 : Può provocare il cancro (indicare la via di esposizione se è definitivamente dimostrato che nessun'altra via di esposizione causa lo stesso pericolo) H373 : Presunto rischio di "effetti gravi sugli organi" (elencare tutti gli organi interessati, se noti) in seguito a ripetizione esposizione o esposizione prolungata (indicare la via di esposizione se è definitivamente dimostrato che nessun'altra via di esposizione non comporta lo stesso pericolo) H412 : Nocivo per la vita acquatica con effetti di lunga durata EUH019 : Può formare perossidi esplosivi P201 : Procurarsi istruzioni speciali prima uso. P210 : Tenere lontano da fonti di calore / scintille / fiamme libere / superfici riscaldate. - Vietato fumare. P261 : Evitare di respirare la polvere / i fumi / i gas / la nebbia / i vapori / gli aerosol. P273 : evitare il rilascio nell'ambiente. P281 : utilizzare i dispositivi di protezione individuale richiesti. P311 : Contattare un CENTRO ANTIVELENI o un medico. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D1A, D2A, B2 : Liquido infiammabile D1A : Materiale molto tossico che causa effetti gravi immediati D2A : Materiale molto tossico che causa altri effetti tossici Divulgazione allo 0,1% secondo i criteri di classificazione |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 2 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trasporto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
33 : materiale liquido altamente infiammabile (punto di infiammabilità inferiore a 21 ° C ) Numero UN : 2389 : FURANNE Classe: 3 Etichetta: 3 : Liquidi infiammabili Confezione: Gruppo di imballaggio I : merci molto pericolose;  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classificazione IARC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo 2B: Possibilmente cancerogeno per l'uomo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotossicologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 |
7 mg · kg -1 (topo, ip ) 5,2 mg · kg -1 (ratti, ip ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | Ratto: 20 ppm per 4 ore | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 1.34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unità di SI e STP se non diversamente specificato. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Il furano , scrive furan , è un composto chimico di formula empirica C 4 H 4 O. È un composto eterociclico appartenente alla classe dei metalloli , costituito da un anello aromatico con cinque atomi , di cui un atomo di ossigeno . È sotto forma di un liquido incolore altamente volatile. Possedendo una reattività diversa da quella del benzene , viene utilizzato come reagente o precursore in chimica organica .
Sintesi
Furan fu sintetizzato per la prima volta nel 1870 da Heinrich Limpricht e fu poi chiamato tetrafenolo .
Sintesi industriale
Una delle principali fonti di furano è l' aldeide furanica , ottenuta per distillazione di derivati vegetali, in particolare cereali. L'aldeide furanica viene quindi catalizzata decarbossilata per produrre furano. Sono note due vie sintetiche:
- Il metodo originale trasforma l'aldeide furanica in furano, idrogeno H 2e anidride carbonica CO 2in presenza di vapore acqueo H 2 Oe un catalizzatore di Zn - Fe o Zn - Mn . La miscela vapore-furfurolo con un rapporto 1: 5-1: 10 viene riscaldata a 400 ° C e la resa in furano è maggiore del 90%.
- Nel 1959, DuPont ha sviluppato un percorso sintetico utilizzando un catalizzatore di platino , che ha permesso di evitare l'uso del vapore. Furfurale è direttamente decomposto in furano e monossido di carbonio pressione e CO ad una temperatura di 200 ° C .
Un'altra possibilità è l'ossidazione parziale dell'1,3-butadiene . Questa tecnica è stata sviluppata da DuPont nel 1957. La reazione utilizza un ossido di molibdeno MoO 3come catalizzatore ad una temperatura di 500 ° C . Vari catalizzatori consentono anche questa reazione: ossido di fosforo e vanadio o ossido di antimonio drogato con stagno , rame o anche tungsteno . Tuttavia, le rese sono inferiori al 15%.
DuPont ha continuato lo sviluppo su questa strada e nel 1987 è stato sviluppato un processo a bassa temperatura (da 90 a 120 ° C ). Il reagente 1,3-butadiene viene vaporizzato e quindi ossidato con dicloruro di rame in una soluzione acquosa di mono- e dicloruro di rame con presenza di cloruro di sodio, ioduro di potassio e acido cloridrico. Si riporta una selettività superiore al 90% per una conversione dell'1,3-butadiene del 20%.
Sintesi di laboratorio
Furano e suoi derivati sostituiti possono essere ottenuti da sistemi aperti, che consente l'accesso diretto a derivati altamente funzionalizzati, in particolare la disidratazione dei pentan-2,4-dioni sostituiti consente l'accesso a 3,4-furani. Sostituito, abbastanza complesso da ottenere con altri percorsi. La sintesi di Paal-Knorr è una delle sintesi più semplici e consente da un 1,4- dichetone e pentossido di fosforo P 4 O 10 per ottenere furano.
La sintesi di Feist-Benary che fa reagire il carbanione di un β-chetoestere con il carbonile di un α-alogeno-chetone e una sostituzione nucleofila intramolecolare avviene per formare un anello che dà all'essiccazione un furano.
Altre sintesi di furano sono possibili da cicloaddizioni o reazioni Diels-Alder .
Proprietà fisico-chimiche
Il furano è un liquido incolore in condizioni normali di temperatura e pressione . È molto volatile e ha un basso punto di ebollizione . Nella NMR del protone , il furano ha due picchi di massa nel cloroformio deuterato CDCl 3 : 7,4 ppm per gli idrogeni α dell'ossigeno , 6,3 ppm per gli idrogeni β. In NMR del carbonio , il furano presenta due picchi a 142 ppm agli atomi di carbonio 1 e 5, 109 ppm agli atomi di carbonio 2 e 4. Il furano è molto solubile in acetone , solubile in metanolo e in etere dietilico e leggermente solubile in acqua. L'indice di rifrazione è 1,421.
Aromaticità
Il furano è un composto aromatico che rispetta la regola di Hückel . Ha sei elettroni delocalizzati: quattro forniti dai doppi legami e due per l'atomo di ossigeno (uno dei due doppietti non leganti ). Ogni carbonio porta uno dei suoi elettroni π nella delocalizzazione e l'ossigeno porta due elettroni. I carboni sono ibridati sp 2 . Il furano ha un'energia di risonanza compresa tra 62,3 e 96,2 kJ mol −1 . Questa energia è inferiore a quella del benzene , del tiofene e del pirrolo : il furano è quindi un composto meno aromatico di quest'ultimo. Questa bassa aromaticità spiega perché il furano agisce come un diene ciclico in alcune reazioni Diels-Alder .
L'atomo di ossigeno ha un effetto donatore mesomerico e un effetto attrattore induttivo nel furano. La delocalizzazione del doppietto non vincolante costituisce l' effetto mesomerico dell'ossigeno, mentre l'attrazione degli elettroni dai legami CO verso l'atomo di ossigeno corrisponde all'effetto induttivo . Il carattere attrattore induttivo influenza la distribuzione degli elettroni nel ciclo ma non riesce a controbilanciare l'effetto mesomerico. L'ossigeno quindi fornisce globalmente una densità elettronica aggiuntiva nel ciclo. Questo contributo elettronico dell'ossigeno si traduce in valori di densità elettronica maggiori di 1 per gli atomi di carbonio del ciclo. L'effetto mesomerico del donatore genera una carica positiva sull'ossigeno nelle quattro forme mesomeriche di furano e una carica negativa delocalizzata sui carboni dell'anello.
L'atomo di ossigeno ha un altro doppietto che non è delocalizzato. Il furano è un composto planare. Come le sue controparti tiofene o pirrolo , il suo ciclo è elettro-surplus. Ha infatti sei elettroni π distribuiti su cinque atomi; la densità elettronica è quindi nettamente superiore a quella degli analoghi del benzene. D'altra parte, a differenza dei semplici anelli aromatici a sei membri, solo una delle sue forme di risonanza è neutra, le altre esistono in forma zwitterionica . Poiché queste forme cariche sono in minoranza, la chimica del furano è in parte derivata da quella degli aromatici e in parte da quella dei dieni.
Reattività del furano
I diversi tipi di reattività
come aromaticoPoiché il furano è elettroeccedente, le reazioni di sostituzione elettrofila aromatica sono notevolmente più veloci rispetto agli analoghi del benzene . Pertanto, è possibile eseguire le reazioni di alogenazione , solfonazione , metallizzazione, ecc. Furan è così reattivo che può subire acilazioni di Friedel-Crafts senza nemmeno la presenza di un catalizzatore .
Le posizioni più favorevoli per le reazioni di sostituzione sono le posizioni 2 e 5 (in α dell'ossigeno). Quando entrambi sono disponibili, è abbastanza difficile fermarsi alla monosostituzione. Quando le posizioni 2 e 5 sono occupate, le reazioni avvengono sulle restanti posizioni.
come dieneIl furano e i suoi derivati possono reagire come dieni oppure come composti aromatici a seconda dei sostituenti sull'anello. Il furano non sostituito reagisce particolarmente bene come diene nelle reazioni di ciclizzazione di tipo Diels-Alders a causa della sua bassa aromaticità. Allo stesso modo, gli alchil furani, gli alcossi furani e gli esteri furfurilici e l' etere hanno una buona reattività nelle reazioni di Diels-Alder . Tuttavia, gli acidi furoici, i nitrofurani e il furfurolo hanno gruppi di ritiro degli elettroni e non reagiscono nemmeno con i dienofili forti. Può reagire con anidride maleica , maleato e fumarato ad alta pressione, acrilato con un catalizzatore ( ioduro di zinco ).
L'idrogenazione totale del furano dà il tetraidrofurano (THF), un solvente ampiamente utilizzato in chimica organica e farmaceutica.
come etereIl furano è un etere ciclico. È particolarmente sensibile alle aperture in un mezzo acquoso acido. È in particolare la fonte di reazioni collaterali, in particolare sui derivati alogenati, che sono particolarmente instabili.
Regioselettività delle sostituzioni
La posizione in cui avverrà una sostituzione dipende dalla stabilità dell'intermedio di reazione. La scrittura delle forme mesomeriche degli intermedi di una sostituzione elettrofila sul furano mostra che una sostituzione è preferibilmente eseguita in posizione 2 o 5 poiché l'intermedio formato ha tre forme mesomeriche . Quando la sostituzione avviene nella posizione 3 o 4, l'intermedio formato ha solo due forme mesomeriche e ha meno stabilità.
Scrivere le forme mesomeriche permette di localizzare le cariche parziali negative del furano nelle posizioni 2, 3, 4 e 5. Tra le forme mesomeriche, la forma non caricata è più rappresentativa perché è più stabile. Tra le forme mesomeriche con cariche, quelle in cui le cariche sono più distanti sono più rappresentative delle forme in cui le cariche sono vicine. Il furano ha solo una forma mesomerica non caricata a differenza del benzene che ha due forme mesomeriche non caricate.
Reazione con acidi
Gli acidi minerali in soluzione acquosa diluiti a freddo non influenzano i furani o gli alchilfurani. Ma quando riscaldati, protonano il furano in posizione 2, producendo un'apertura del furano e la formazione di composti dicarbonilici. Inoltre, acidi forti concentrati ( acido solforico , acido nitrico fumante) o acidi di Lewis provocano la polimerizzazione del furano e dei suoi derivati alchilici.
I sostituenti furani influenzano la reattività agli acidi . I furani sostituiti da gruppi di ritiro di elettroni sono relativamente stabili in un mezzo acido perché l'anello è meno caricato elettronicamente e quindi meno reattivo. D'altra parte, i furani sostituiti da gruppi donatori di elettroni sono facilmente aperti o polimerizzati in un mezzo acido. Infatti, i sostituenti elettroni donatori facilitano l'attacco di un protone in posizione 2 del furano.
Sostituzione nucleofila aromatica
Furan non reagisce con i reagenti nucleofili. Tuttavia, alcuni furani aventi gruppi di ritiro di elettroni possono subire la sostituzione nucleofila di questi gruppi.
Sostituzione elettrofila aromatica
Il furano è più reattivo del tiofene e del benzene nei confronti dei reagenti elettrofili, ma meno reattivo del pirrolo .
La nitrazione furanica viene effettuata con l' anidride acetica H 3 C-CO-O-CO-CH 3e acido nitrico HNO 3a bassa temperatura. Si forma prima il 2-nitrofurano e poi, se la reazione continua, il 2,5-dinitrofurano. La nitrazione forma un composto isolabile non aromatico che può perdere una molecola di acido acetico CH 3 COOHdall'azione di una base come la piridina o dalla solvolisi .
La solfonazione viene effettuata a temperatura ambiente per azione del complesso piridina - triossido di zolfo per produrre un composto monosolfonato.
L'alchilazione in condizioni di Friedel-Crafts non è possibile e si traduce in una miscela di prodotti e polimeri . Tuttavia, il furano viene acilato in presenza di un acido di Lewis con cloruri di acido o anidridi . La sostituzione avviene in posizione 2. La reazione Vilsmeier-Haack permette di aggiungere un gruppo formile in posizione 2 del furano. La reazione di Mannich non funziona con il furano ma si applica agli alchil furani che hanno una posizione libera 2 o 5.
uso
Il furano è utilizzato principalmente come precursore nella chimica fine. Mediante l'idrogenazione del furano si può ottenere il tetraidrofurano (THF) , utilizzato principalmente come solvente. L'ossidazione in presenza di bromo nel metanolo dà 2,5-dimetossi-2,5-diidrofurano , utilizzato in fotografia. È anche un precursore di prodotti fitosanitari come l' endothall .
Furan è anche utilizzato come blocco per la formazione di polimeri che vengono utilizzati come additivi per prodotti per la pulizia e detersivi per bucato. Il vantaggio di tali additivi è che non contengono azoto o fosforo.
Tossicologia
Queste sostanze hanno un carattere lipofilo (si dissolvono nel grasso) e contaminano l'uomo principalmente attraverso l'apparato digerente (cibo contaminato in particolare).
Durante l'avvelenamento acuto, si verifica un'acne particolare (cloracne) sul viso e sul tronco. Si verificano anche danni ai nervi periferici (formicolio, dolore alle mani o ai piedi e disturbi del riflesso miotatico). Viene descritto anche l'irsutismo. Infine, troviamo danni al fegato, alla glicemia (diabete) e al metabolismo dei grassi.
È noto un aumento dei tumori, senza localizzazione specifica, che riguarda principalmente il sangue (linfoma, mieloma), i tessuti molli, i polmoni e il fegato.
Regolamento
- Nel 2011 l'EFSA ha aggiornato i suoi dati sui livelli di furano negli alimenti. Tuttavia, al momento, nessun regolamento stabilisce i livelli massimi autorizzati nei prodotti alimentari.
In assenza di regolamentazione, le capsule di caffè sono state recentemente interrogate per la presenza di furano. Tuttavia, diverse azioni, come fornire aria fresca durante la tostatura dei semi (o mescolare il caffè con un cucchiaio), riducono drasticamente il livello di contaminazione.
Bibliografia
- (fr) R. Milcent, F. Chau Organic Heterocyclic Chemistry , EDP Sciences.
Vedi anche
Composti strutturalmente o chimicamente correlati:
- Tetraidrofurano , furano saturo, ampiamente usato come solvente
-
Furani sostituiti
- Furanosio , furano sostituito da gruppi idrossilici
- Furfurolo , furano sostituito da un gruppo aldeidico
- Acido furoico , furano sostituito da un gruppo carbossilico
- Alcool furfurilico
-
Furani legati ai cicli
- Benzofurano , furano legato a un benzene
- Dibenzofurano , furano legato a due benzeni
- Dibenzo-furano policlorurato
- Analoghi del furano
Riferimenti
- FURANNE , scheda / i di sicurezza del Programma internazionale sulla sicurezza delle sostanze chimiche , consultato il 9 maggio 2009
- (a) David R. Lide, Manuale di chimica e fisica , Boca Raton, CRC, 16 giugno 2008, 89 ° ed. , 2736 p. ( ISBN 978-1-4200-6679-1 e 1-4200-6679-X ) , p. 9-50
- (it) Yitzhak Marcus, Le proprietà di solventi , vol. 4, Inghilterra, John Wiley & Sons Ltd,1999, 239 p. ( ISBN 0-471-98369-1 )
- massa molecolare calcolata dal " peso atomico degli elementi 2007 " su www.chem.qmul.ac.uk .
- (en) ChemIDplus , " Furan - RN: 110-00-9 " , su chem.sis.nlm.nih.gov , US National Library of Medicine (accesso 17 dicembre 2008 )
- (in) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 ° ed. , 1076 p. ( ISBN 978-0-387-69002-5 e 0-387-69002-6 , leggi online ) , p. 294
- (in) JG Speight, Norbert Adolph Lange, Manuale di chimica di Lange , McGraw-Hill,2005, 16 ° ed. , 1623 p. ( ISBN 0-07-143220-5 ) , p. 2.289
- (en) Robert H. Perry e Donald W. verde , di Perry Chemical Engineers' Handbook , Stati Uniti d'America, McGraw-Hill,1997, 7 ° ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- " Properties of Various Gases " su flexwareinc.com (accesso 12 aprile 2010 )
- (in) Carl L. Yaws, Handbook of Thermodynamic Diagrams , Vol. 1, Huston, Texas, Gulf Pub. Co.,1996( ISBN 0-88415-857-8 )
- (a) David R. Lide, Manuale di chimica e fisica , Boca Raton, CRC,2008, 89 ° ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 10-205
- Gruppo di lavoro IARC sulla valutazione dei rischi cancerogeni per gli esseri umani, " Valutazioni Globales de la Carcinogenicité pour l'Homme, Gruppo 2B: Possibilmente cancerogeno per l'uomo " , su http://monographs.iarc.fr , IARC, 16 gennaio 2009(visitato il 22 agosto 2009 )
- Numero indice nella tabella 3.1 dell'appendice VI del regolamento CE n. 1272/2008 (16 dicembre 2008)
- Entry "Furano" nel database chimica GESTIS dell'IFA (ente tedesco responsabile per la sicurezza sul lavoro e la salute) ( tedesco , inglese ), si accede 19 aprile 2011 (JavaScript necessari)
- SIGMA-ALDRICH
- " Furanne " nel database delle sostanze chimiche Reptox del CSST (organizzazione del Quebec responsabile per la sicurezza e la salute sul lavoro), accesso 25 aprile 2009
- "furan" , su ESIS , consultato il 17 febbraio 2009
- (en) H.Limpricht, " Ueber das tetraphenol C 4 H 4 O " , Berichte der deutschen chemischen Gesellschaft , vol. 3, n o 1, 1870, p. 90-91 ( DOI 10.1002 / cber.18700030129 )
- (en) HE Hoydonckx, WM Van Rhijn, W. Van Rhijn, DE De Vos e PA Jacobs, "Furfural and Derivatives" , in Encyclopedia of Industrial Chemistry di Ullmann ,2007( sommario )
- (a) Agenzia di Scienza e Tecnologia Industriale , " RIO-DB Informazioni Research Database pagina " su http://riodb01.ibase.aist.go.jp , Tsukuba Advanced Computing Centre (accessibile 14 luglio 2008 )
- sito di chimica http://www.sciencelab.com/xMSDS-Furan-9927174
- Sigma, http://www.sigmaaldrich.com/catalog/ProductDetail.do?N4=185922%7CALDRICH&N5=SEARCH_CONCAT_PNO%7CBRAND_KEY&F=SPEC
- Strutture fondamentali di chimica organica eterociclica, René Milcent, François Chau
- Sito Heterochemistry http://www.cem.msu.edu/~reusch/VirtualText/heterocy.htm
- (in) HR Kottke "Furan Derivatives" in "Kirk-Othmer Encyclopedia of Chemical Technology" 1998; John Wiley & Sons: New York
- diossine e furani. ED 5024. INRS. 2006
- EFSA 01/09/11 L' EFSA pubblica una relazione aggiornata sui livelli di furano negli alimenti
- MS Altaki, FJ Santos, MT Galceran, "Occurrence of furan in coffee from Spanish market: contributo of brewing and roasting", Food Chemistry , 2011, 126 (4), 1527









