Acidi del vino
Il vino acido è un elemento importante sia nel vino che nel vino finito. Sono presenti sia nell'uva che nel vino, influenzando direttamente il colore, l' equilibrio e il gusto del vino, nonché la crescita e la vitalità del lievito durante la fermentazione e proteggendo il vino dai batteri .
La misura della quantità di acidità nel vino si chiama "acidità titolabile" o "acidità totale", che corrisponde al test che dà il totale di tutti gli acidi presenti, mentre la forza dell'acidità viene misurata in base al pH , con la maggior parte vini con un pH compreso tra 2.9 e 3.9. Come regola generale, più basso è il pH, maggiore è l'acidità del vino. Tuttavia, non esiste un legame diretto tra acidità totale e pH (è possibile trovare vini con un pH elevato per il vino e un'elevata acidità).
In degustazione , il termine "acidità" si riferisce agli attributi freschi, croccanti e aspri del vino che vengono valutati in relazione a come l'acidità si bilancia sulle componenti dolci e amare del vino come i tannini . Tre acidi primari sono presenti nell'uva da vino: acido tartarico , malico e citrico . Durante la vinificazione e nei vini finiti, gli acidi acetico , butirrico , lattico e succinico possono svolgere ruoli importanti. La maggior parte degli acidi coinvolti nel vino sono acidi fissi, con la notevole eccezione dell'acido acetico, che si trova principalmente nell'aceto, che è volatile e può contribuire all'inestetismo del vino chiamato “ puntura acetica ”. A volte nella vinificazione vengono utilizzati acidi aggiuntivi, come gli acidi ascorbico , sorbico e solforoso .
Acido tartarico
L'acido tartarico è, dal punto di vista enologico, il più importante per il ruolo preponderante che svolge nel mantenimento della stabilità chimica del vino, nel sostenerne il colore dall'elevato contenuto di acidità, e infine nell'influenza del gusto di il vino finito. La forte resistenza chimica del vino è infatti influenzata da un'elevata percentuale di acido, che conferisce al vino un migliore potenziale di invecchiamento. Nella maggior parte delle piante questo acido organico è raro, ma si trova in concentrazioni significative nelle viti . Insieme all'acido malico e, in misura minore, all'acido citrico, il tartarico è uno degli acidi fissi presenti nell'uva da vino. La concentrazione varia a seconda del vitigno e del contenuto di suolo del vigneto. Alcuni vitigni, come il palomino , sono naturalmente inclini ad avere alti livelli di acido tartarico, mentre il malbec e il pinot nero hanno generalmente livelli più bassi. Durante la fioritura , alti livelli di acido tartarico sono concentrati nei fiori d'uva e poi negli acini giovani. Man mano che la vite matura, l'acido tartarico non viene metabolizzato dalla respirazione come l'acido malico. Man mano che le bacche maturano, la concentrazione di acido tartarico diminuisce. A causa dell'aumento delle dimensioni degli acini, la percentuale costantemente elevata di acido tartarico è sempre più diluita.
Sebbene vi siano differenze tra i vitigni e le regioni vinicole, circa la metà dei depositi sono generalmente solubili nella miscela alcolica del vino, con la maggior parte della concentrazione presente come sale acido di potassio . Durante la fermentazione, questi tartrati si combinano cristallizzando da fecce, residui di polpa, tannini e pigmenti precipitati. I cristalli tartari influiscono sulla limpidezza del vino e possono quindi ridurre il piacere della degustazione. La cristallizzazione di questi tartrati può avvenire in momenti imprevedibili e in una bottiglia di vino può sembrare un vetro rotto. La scala si osserva nella bottiglia a seconda del tipo di conservazione sul tappo o sul fondo. Il tartaro è insapore e si sente come la sabbia in bocca. Poiché questo innocuo deposito ha dato spesso luogo a lamentele (infondate), molti dei vini tradizionali odierni subiscono la cosiddetta stabilizzazione “tartarica”. Per questo, i viticoltori raffredderanno il vino a 4 ° C o meno per due settimane per favorire la cristallizzazione e la precipitazione dei tartrati del vino o per procedere con un'elettrodialisi che li elimina mediante un processo a membrana.
Il contenuto di acido tartarico può essere facilmente determinato con un test rapido (Rebelein). L'acido tartarico nel vino viene convertito con un derivato dell'ammonio, il monovanadato di ammonio, in un complesso giallo-arancio. L'intensità della colorazione viene misurata otticamente ad una lunghezza d'onda di 540 nm mediante fotometria. Il contenuto di acido tartarico viene letto in una tabella di conversione.
Acido malico
L'acido malico, insieme all'acido tartarico, è uno dei principali acidi organici presenti nell'uva da vino. Si trova in quasi tutti i frutti e le piante di bacche , ma è più spesso associato alle mele verdi (acerbe), l'aroma che trasmette più facilmente al vino. Il suo nome deriva dal latino malum che significa "mela". In vigna l'acido malico si forma nel tessuto contenente la clorofilla dell'acino dal metabolismo degli zuccheri ed è coinvolto in diversi processi fondamentali per la salute e la sostenibilità della vite. La sua struttura chimica gli permette di partecipare alle reazioni enzimatiche che trasportano energia in tutta la vite. La sua concentrazione varia a seconda del vitigno e alcune varietà, come barbera , carignan , colombard , riesling e sylvaner , lo hanno naturalmente a livelli elevati. I livelli di acido malico negli acini d'uva sono al loro picco appena prima dell'invaiatura e possono raggiungere i 20 g / l . Man mano che la vite progredisce durante la fase di maturazione dell'acino, l'acido malico viene metabolizzato durante il processo respiratorio e verso la coltura , la sua concentrazione può raggiungere da 1 a 9 g / l . L'acido malico è un buon indicatore per verificare che la maturità del frutto non sia stata ancora raggiunta. La quantità di acido malico che rimane a maturità dipende dall'annata, dalla zona di coltivazione e dal microclima, ed è quindi una causa importante delle differenze qualitative legate all'annata o al luogo. Il tasso di degradazione dipende fortemente dalla temperatura e può essere maggiore del tasso di maturazione fisiologica, specialmente ad alte temperature notturne. La perdita respiratoria di acido malico è più pronunciata nei climi più caldi. Quando tutto l'acido malico è utilizzato nell'uva, è considerato "troppo maturo" o senescente . I mosti a bassa acidità producono vini piatti e non sono sufficientemente stabili dal punto di vista microbico. I produttori di vino devono compensare questa perdita aggiungendo acido estraneo alla cantina in un processo chiamato acidificazione.
L'acido malico può essere ulteriormente ridotto durante il processo di vinificazione della fermentazione malolattica (FML). In questo processo, i batteri convertono l'acido malico più aggressivo in acido lattico più debole. Per alcuni vini, questa conversione può essere utile, soprattutto se il vino ha livelli eccessivi di acido malico. Per altri vini come Chenin Blanc e Riesling , questo prodotto ha un sapore (come l'odore del burro di diacetile ) che non sarebbe attraente per queste varietà. Nelle uve sane, sugli acini si trovano solo piccole quantità di batteri lattici . I batteri all'origine di questo processo si trovano naturalmente in cantina, nelle botti che producono botti di rovere e ospiteranno una popolazione di batteri, oppure potranno essere introdotti dal vignaiolo con esemplari coltivati. La fermentazione malolattica, un tempo sporadica e spontanea, viene ora svolta in modo mirato, in particolare nei vini rossi. Questa fermentazione viene sempre svolta in botte di legno con fermenti lattici inoculati. In generale, i vini rossi sono più spesso soggetti a FML rispetto ai bianchi, il che aumenta la probabilità di trovare acido malico nei vini bianchi (sebbene le eccezioni notevoli, come lo chardonnay , siano spesso soggette a FML).
Formalmente, l'acido malico è poliprotico (fornisce diversi protoni, qui due), mentre l'acido lattico è monoprotico (contribuisce a un protone) e quindi ha solo la metà dell'effetto sull'acidità (pH); allo stesso modo, la prima costante di acidità (p K a ) dell'acido malico (3,4 a temperatura ambiente) è inferiore alla costante di acidità (unica) dell'acido lattico (3,86 a temperatura ambiente), indicando un'acidità più forte. Quindi, dopo la FML, il vino ha un pH più alto (meno acido) e una sensazione in bocca diversa.
Acido lattico
Molto più dolce del tartarico e del malico, l'acido lattico è spesso associato ai sapori “ lattiginosi ” nel vino ed è l'acido primario nello yogurt e nei crauti . L'acido monocarbossilico non si trova naturalmente nelle bacche. È prodotto durante la vinificazione dai batteri lattici (LAB), che comprendono tre generi : oenococcus , pediococcus e lactobacillus . Questi batteri convertono sia lo zucchero che l'acido malico in acido lattico, quest'ultimo tramite la fermentazione malolattica. Anche l'anidride carbonica si forma come sottoprodotto. I meccanismi della fermentazione malolattica sono stati compresi solo a partire dagli anni '60 e da allora sono stati utilizzati specificamente nella produzione di vino. Questo processo può essere benefico per alcuni vini, aggiungendo complessità e ammorbidendo l'asprezza dell'acidità malica, ma può trasformare alcuni aromi e generare torbidità in altri, se la degradazione dell'acido non è controllata. I vini bianchi, ad esempio, perdono il loro fruttato e quindi non sono sempre i benvenuti a subire una degradazione acida. I vini a base di Chenin Blanc o Riesling generalmente perdono la loro qualità. Alcuni ceppi di batteri lattici possono produrre ammine biogene , come istamina , tiramina , putrescina e feniletilamina , che possono causare mal di testa in alcuni bevitori di vino. I produttori di vino che desiderano controllare o prevenire la fermentazione malolattica possono utilizzare l' anidride solforosa per eliminare i batteri. Rimuovere rapidamente il vino dalle sue fecce aiuterà anche a controllare i batteri, poiché le fecce sono una fonte di cibo vitale per loro. I produttori di vino devono anche stare molto attenti con le botti e le attrezzature per la vinificazione a cui il vino è esposto, a causa della capacità dei batteri di scavare in profondità nelle fibre del legno. Lo sviluppo in botte è quindi problematico se il vino non deve effettuare la fermentazione malolattica. Inoltre, una botte di vino che ha completato con successo la fermentazione malolattica quasi sempre indurrà la fermentazione malolattica in ogni vino immagazzinato.
Acido citrico
Sebbene molto diffuso negli agrumi , come la calce , l'acido citrico si trova solo in quantità molto piccole nell'uva da vino. Spesso ha una concentrazione di circa 1/20 di quella dell'acido tartarico, cioè in proporzioni da 0,1 a 0,4 g / l . L'acido citrico che si trova più frequentemente nel vino è costituito da acidi integratori (fino a 0,5 g / l ) Prodotto commercialmente e soluzioni derivate saccarosio in fermentazione . Questi integratori economici possono essere utilizzati nell'acidificazione dei viticoltori per aumentare l'acidità totale del vino. Con queste piccole quantità aggiuntive, l'acido non può essere rilevato sensualmente e aiuta i vini a bassa acidità ad avere più struttura e freschezza. È meno utilizzato del tartarico e del malico a causa degli aromi agrumati aggressivi che può aggiungere al vino. L'aggiunta di acido citrico avviene sempre dopo la fermentazione alcolica, nel vino microbiologicamente stabile, per la tendenza del lievito a convertire l'acido citrico in acido acetico. In caso di fermentazione malolattica, l'acido citrico viene degradato dai batteri lattici. Nell'Unione Europea , l'uso dell'acido citrico per l'acidificazione è vietato, ma è autorizzato l'uso limitato di acido citrico per rimuovere dal vino il ferro e il rame in eccesso se il ferrocianuro di potassio n 'non è disponibile. Il limite è 1 g / l .
Altri acidi
L' acido acetico è un acido organico con due atomi di carbonio prodotto nel vino durante o dopo il periodo di fermentazione. È il più volatile degli acidi primari associati al vino ed è responsabile del sapore aspro dell'aceto . Durante la fermentazione, l'attività delle cellule di lievito produce naturalmente una piccola quantità di acido acetico. Se il vino è esposto all'ossigeno , i batteri Acetobacter convertiranno l' etanolo in acido acetico. Questo processo è noto come acetificazione del vino ed è il processo principale nella scomposizione del vino in aceto. Una quantità eccessiva di acido acetico è considerata un difetto del vino . La sensibilità di un degustatore all'acido acetico varia, ma i degustatori sensibili possono rilevare un morso acetico già a una concentrazione di 0,5 g / l . I vini bianchi sono considerati viziati dai regolamenti con più di 1,08 g / le i vini rossi, a causa dei tannini più forti, con più di 1,2 g / l . Un vero morso acetico non si nota in questi vini al naso fino a 1,5 g / l di acidità volatile . I vini dolci sono un'eccezione, poiché gli aromi concentrati possono nascondere un leggero pungiglione. In questo caso, il limite massimo legale è 1,8 g / l . L'acido acetico può essere già presente nel mosto, ad esempio, quando la grandine o il morso di uccelli danneggiano l'uva ei batteri sulla buccia dell'uva entrano in contatto con lo zucchero negli acini. In casi estremi, anche in vigna, si nota una leggera puntura.
L' acido ascorbico , noto anche come vitamina C, si trova nelle uve giovani prima dell'invaiatura, ma si perde rapidamente durante il processo di maturazione. Il suo contenuto nell'uva è inferiore a 20 mg / l, cioè dieci volte inferiore a quello degli agrumi. In vinificazione viene utilizzato con anidride solforosa come antiossidante , spesso aggiunto durante l'imbottigliamento dei vini bianchi. Nell'Unione Europea, l'uso dell'acido ascorbico come additivo è limitato a 150 mg / l .
L' acido butirrico è un difetto del vino indotto da batteri che possono provocare odore di camembert , di parmigiano o burro / grasso rancido . L'acido butirrico può essere il risultato di una fermentazione malolattica impropria.
L' acido sorbico è un additivo per vino spesso utilizzato nel vino dolce come conservante contro la crescita di funghi , batteri e lieviti. A differenza dell'anidride solforosa, non interferisce con la crescita dei batteri lattici . Nell'Unione Europea, la quantità di acido sorbico che può essere aggiunta è limitata - non più di 200 mg / l . Spesso l'acido viene utilizzato sotto forma di sorbato di potassio (max 275 mg / l ). La maggior parte degli esseri umani ha un limite di rilevamento di 135 mg / l , alcuni hanno una sensibilità per rilevare la sua presenza a 50 mg / l . L'acido sorbico può produrre aromi e sapori che possono essere descritti come "rancidi". Se dopo l'aggiunta dell'acido si avvia involontariamente la fermentazione malolattica, i fermenti lattici metabolizzano i sorbati nel vino, e questo crea un difetto nel vino che è riconoscibile da un aroma di foglie di Geranio schiacciate. Il composto responsabile è il 2-etossiesa-3,5-diene, la cui soglia di rilevamento è molto bassa ( 0,001 mg / l ).
L' acido succinico si trova più spesso nel vino, ma può anche essere presente in tracce nell'uva matura. Sebbene la concentrazione vari tra le uve, di solito si trova a livelli più alti con le uve rosse. L'acido viene creato come sottoprodotto del metabolismo dell'azoto dalle cellule di lievito durante la fermentazione. È autorizzato nell'UE come additivo alimentare con il numero E363 e serve, ad esempio, come esaltatore di sapidità . Mentre l'acido succinico ha un gusto leggermente amaro e salato, il monometilsuccinato esterificato apporta al vino una leggera componente fruttata.
La tabella seguente fornisce una panoramica degli acidi organici rilevabili nel vino.
| Designazione | Nome IUPAC | Formula strutturale |
Massa molare (g / mol) |
Acidità costante |
Origine |
|---|---|---|---|---|---|
| Acido tartarico | Acido 2,3-diidrossibutandioico |
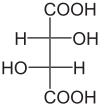
|
150 | 3.01 / 4.37 | Bacca sana |
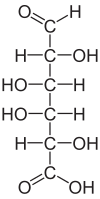
| Acido malico | Acido 2-idrossibutandioico |

|
134.09 | 3.46 / 5.13 | Bacca sana |
| Acido citrico | Acido 2-idrossipropan-1,2,3-tricarbossilico |
|
192.43 | 3.14 / 5.74 | Bacca sana |
| Acido ascorbico | ( R ) -5 - [( S ) -1,2-diidrossietil] -3,4-diidrossi-5 H -furan-2-one |
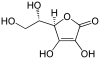
|
176.13 | 4.10 | Bacca sana |
| Acido ossalico | acido etanedioico |
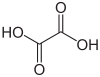
|
90.04 | 1.27 / 4.28 | Bacca sana |
| Acido glicolico | acido idrossiacetico |

|
76.05 | 3.83 | Bacca sana |
| Acido fumarico | acido trans- butenedioico |

|
116.07 | 3.03 / 4.44 | Bacca sana |
| Acido glucuronico | Acido 3,4,5,6-tetraidrossitetraidropiran-2-carbossilico |

|
194.14 | Bacca sana + Botrytis | |
| Acido galatturonico |
|
194.14 | Bacca sana + Botrytis | ||
| Acido gluconico | Acido 2,3,4,5,6-pentaidrossiesanoico |

|
196.16 | 3.86 | Bacca sana + Botrytis |
| Acido mucico | Acido 2,3,4,5-tetraidrossiadipico |

|
210.14 | Bacca sana + Botrytis |
In vinificazione
L'acidità è massima nelle uve da vino poco prima dell'inizio dell'invaiatura , che inaugura il periodo di maturità del ciclo annuale delle viti. Man mano che le uve maturano, i loro livelli di zucchero aumentano e la loro acidità diminuisce. Attraverso il processo di respirazione , l'acido malico viene metabolizzato dalla vite. Le uve provenienti da regioni vinicole con clima più fresco hanno generalmente livelli di acidità più elevati a causa del processo di maturazione più lento. Il livello di acidità ancora presente nell'uva è un fattore importante da considerare per i vignaioli al momento di decidere quando iniziare la vendemmia . Per vini come lo champagne e altri spumanti, quindi, un'acidità elevata è ancora più vitale nel processo di vinificazione , quindi le uve vengono spesso raccolte a maturità e con livelli di acidità più elevati.
Nel processo di vinificazione, gli acidi aiutano a migliorare l'efficienza dell'anidride solforosa per proteggere i vini dal deterioramento e possono anche proteggere il vino dai batteri a causa dell'incapacità della maggior parte dei batteri di sopravvivere in soluzioni a pH basso. Due notevoli eccezioni sono l' acetobacter e i batteri lattici. Nei vini rossi l'acidità aiuta a preservare e stabilizzare il colore del vino. La ionizzazione degli antociani è influenzata dal pH, quindi i vini con pH più basso (come i vini a base di Sangiovese ) hanno colori più rossi e più stabili. I vini con un pH più elevato (come i vini a base di Syrah ) hanno livelli più elevati di pigmenti blu meno stabili, che alla fine assumono una sfumatura grigiastra fangosa. Questi vini possono anche sviluppare una tinta brunastra. Nei vini bianchi, un pH più elevato (bassa acidità) fa sì che i composti fenolici nel vino si scuriscano e alla fine polimerizzino come depositi marroni.
I produttori di vino a volte aggiungono acidi al vino (acidificazione) per renderlo più acido, il più delle volte nei climi caldi dove le uve vengono spesso raccolte in una fase avanzata di maturità con alti livelli di zuccheri ma molto bassi di acido. L'acido tartarico è più spesso aggiunto, ma i produttori di vino a volte aggiungono acido citrico o malico. Gli acidi possono essere aggiunti prima o dopo la fermentazione primaria. Possono essere aggiunti durante la miscelazione o l'invecchiamento, ma la maggiore acidità diventerà più evidente agli assaggiatori se aggiunta a questo punto.
Nella degustazione di vini
L'acidità del vino è una parte importante della qualità e del gusto del vino. Aggiunge nitidezza agli aromi ed è più facilmente individuabile da una sensazione di formicolio ai lati della lingua e da un retrogusto appetitoso. Particolarmente importante è l'equilibrio tra l'acidità, la dolcezza del vino ( zucchero residuo ) e le componenti più amare del vino (in particolare i tannini ma anche altri composti fenolici ). Un vino troppo acido avrà un gusto eccessivamente acido e vivace. Un vino con poca acidità avrà un gusto morbido e piatto, con aromi meno definiti. Ci sono una moltitudine di descrittori che qualificano l'impressione gustativa determinata dall'acido: pungente, verde, vivace, croccante, sapido, frizzante, nervoso.
Note e riferimenti
- (en) / (de) Questo articolo è parzialmente o interamente tratto dagli articoli intitolati in inglese " Acids in wine " ( vedi elenco autori ) e in tedesco " Säure (Wein) " ( vedi elenco autori ) .
- (a) RB Bellman e JF Gallander , Advances in Food Research , vol. 25, Academic Press; Chichester, CO; Mrak, Emil Marcel; Stewart, George Franklin,1979, 3 p. ( ISBN 0-12-016425-6 , leggi online ) , "Wine Deacidification"
- (in) J. Robinson (ed.), The Oxford Companion to Wine , 3 e ed. , p. 2-3 , Oxford University Press , 2006 ( ISBN 0-19-860990-6 )
- (a) J. Robinson (ed.), The Oxford Companion to Wine , 3 e ed. , p. 681 , Oxford University Press, 2006 ( ISBN 0-19-860990-6 )
- (de) Bestimmung der Weinsäure (nach Rebelein) Universität Hohenheim.
- (a) J. Robinson (ed.), The Oxford Companion to Wine , 3 e ed. , p. 421-422 , Oxford University Press, 2006 ( ISBN 0-19-860990-6 )
- (in) J. Robinson (a cura di), The Oxford Companion to Wine , 3 e ed. , p. 387 , Oxford University Press, 2006 ( ISBN 0-19-860990-6 )
- (in) J. Robinson (a cura di), The Oxford Companion to Wine , 3 e ed. , p. 171 , Oxford University Press, 2006 ( ISBN 0-19-860990-6 )
- (in) J. Robinson (a cura di), The Oxford Companion to Wine , 3 e ed. , p. 35-36 , Oxford University Press, 2006 ( ISBN 0-19-860990-6 )
- (in) Two Mountain Retreats, 2 States and Both Dedicated to Wine [PDF] , Sommelier News , ottobre 2003, vol. 3, n o 67AJ, p. 10 , International Sommelier Guild (accesso 30 settembre 2018).
- (in) J. Robinson (a cura di), The Oxford Companion to Wine , 3 e ed. , p. 644 , Oxford University Press, 2006 ( ISBN 0-19-860990-6 )
- (in) J. Robinson (a cura di), The Oxford Companion to Wine , 3 e ed. , p. 665 , Oxford University Press, 2006 ( ISBN 0-19-860990-6 )
Bibliografia
- .
- Pascal Ribéreau-Gayon , Yves Glories, Alain Maujean e Denis Dubourdieu , Trattato di enologia: Chimica del vino - Stabilizzazione e trattamenti , t. 2, Dunod ,2012, 6 ° ed. , 624 p. ( ISBN 2100588753 , leggi online ).
Vedi anche
Articoli Correlati
link esterno
- " Gli acidi " , su Wine è successo? .
- Carole Feilhes, " Acidi d'uva organici " , sull'Istituto francese della vite e del vino .
- " L'acidità nel tuo bicchiere di vino " , su Bordeaux Wine Campus ,2 giugno 2015.
- Pascal-Antoine Christin e Olivier Junod, " La chimica del vino - Composizione del vino " , su Futura ,3 ottobre 2019.