Acido metanoico
| acido metanoico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule di Lewis e 3D per l'acido metanoico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificazione | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome IUPAC | Acido metanoico | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinonimi |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.527 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CE | 200-579-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E236 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2487 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SORRISI |
C (= O) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / CH2O2 / c2-1-3 / h1H, (H, 2,3) / f / h2H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | odore liquido incolore, fumoso, pungente | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà chimiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formula bruta |
C H 2 O 2 [Isomeri] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa molare | 46,0254 ± 0,0015 g / mol C 26,1%, H 4,38%, O 69,52%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 3,751 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Momento dipolare | 1,425 ± 0,002 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diametro molecolare | 0,381 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusione | 8,3 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° bollitura | 101 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilità |
1000 g · l -1 (acqua, 25 ° C ), |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametro di solubilità δ |
24,8 MPa 1/2 ( 25 ° C ); 21,4 J 1/2 · cm -3/2 ( 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
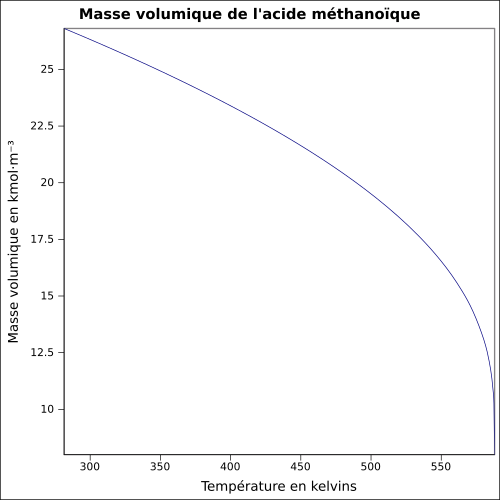
| Massa volumica | 1,22 a 25 ° C
equazione:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura di autoaccensione | 520 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto d'infiammabilità | 69 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limiti di esplosività in aria | 14 - 34 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressione del vapore saturo |
42,6 mmHg ( 25 ° C )
equazione:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viscosità dinamica | 1.57 × 10 -3 Pa s a 26 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto critico | 306,85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto triplo | 281,45 K ( 8,3 ° C ) 23,6 mbar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochimica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gas, 1 bar | 248,7 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 liquido, 1 bar | 131,8 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gas | −378,6 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 liquido | −425,1 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
45,7 J · mol -1 · K -1 (vapore) 99,0 J · mol -1 · K -1 (liquido) equazione:
equazione:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PC | 254,6 kJ · mol -1 ( 25 ° C , liquido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà elettroniche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re energia di ionizzazione | 11,33 ± 0,01 eV (gas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà ottiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indice di rifrazione | 1.3694 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauzioni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Pericolo H226, H302, H314, H331, H226 : Liquido e vapori infiammabili H302 : Nocivo se ingerito H314 : Provoca gravi ustioni cutanee e gravi lesioni oculari H331 : Tossico per inalazione |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B3, E, B3 : punto di infiammabilità del liquido combustibile = 46,5 ° C vaso chiuso (metodo non riportato) E : materiale corrosivo Trasporto di merci pericolose: classe 8 Divulgazione all'1,0% secondo l'elenco di divulgazione degli ingredienti |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trasporto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1779 : ACIDO FORMICO |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inalazione | I vapori concentrati sono corrosivi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ingestione | Tossico, può causare reazioni allergiche. Sospetto agente mutageno | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotossicologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 |
700 mg · kg -1 (topo, orale ) 145 mg · kg -1 (topo, iv ) 940 mg · kg -1 (topo, ip ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | -0,54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soglia di odore | basso: 1,6 ppm alto: 340 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unità di SI e STP se non diversamente specificato. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L' acido metanoico (noto anche come acido formico ) è il più semplice degli acidi carbossilici . La sua formula chimica è C H 2 O 2 o HCOOH. La sua base coniugata è lo ione metanoato (formiato) con la formula HCOO - . È un acido debole che si presenta sotto forma di un liquido incolore con un odore penetrante.
In natura si trova nelle ghiandole di diversi insetti dell'ordine degli Imenotteri , come api e formiche , ma anche sui peli che compongono le foglie di alcune piante della famiglia delle urticaceae ( ortiche ). Il suo nome formico banale deriva dalla parola latina formica che significa formica, perché fu isolata per la prima volta per distillazione di formiche.
Storia
Dal XV ° secolo, alcuni alchimisti e naturalisti erano consapevoli del fatto che alcune formiche , in particolare il tipo di formica , producendo un vapori di acido . La prima persona ad aver descritto l'isolamento di questa sostanza (per distillazione di un gran numero di corpi di formiche) è l' inglese naturalista John Ray nel 1671. La sua prima sintesi è stata fatta dal francese chimico Gay-Lussac da l ' acido cianidrico . Nel 1855, un altro chimico francese, Marcellin Berthelot , sviluppò un metodo di sintesi dal monossido di carbonio , simile a quello usato oggi. L'acido formico è presente nella composizione della maggior parte dei veleni delle formiche, che lo spruzzano o lo applicano direttamente per perforare la cuticola di altri artropodi o respingere eventuali predatori .
Chimica
Proprietà riducenti
Riscaldato con acido solforico , l'acido formico si decompone in acqua e monossido di carbonio , quindi ha proprietà riducenti molto spiccate (riduzione di sali di oro , argento , rame , ecc.). Sotto l'azione del solo calore, si decompone a circa 160 ° C in idrogeno e anidride carbonica , ottenendo nuovamente proprietà riducenti.
Acido debole
Sebbene sia più ionizzato delle sue controparti di acido carbossilico superiore, è un acido debole , ma nonostante ciò è in grado di spostare l'acido nitrico dai suoi sali. Se l'acido formico viene aggiunto a una miscela di nitrato di potassio e brucina , la miscela diventa immediatamente rossa. Non fornisce anidride acida e fornisce come equivalente alogenuro acilico il fosgene COCl 2 .
Produzione
Riscaldando cloruro di potassio e monossido di carbonio in un tubo sigillato , Berthelot ha sintetizzato acido formico: CO + KOH → H-CO 2 K, quindi, sotto una pressione di 7 atm. ea 170 ° C , idrolisi del formiato di potassio H - CO 2 K con acido solforico ; il prodotto ottenuto per distillazione a pressione ridotta contiene dall'80 all'85% di acido formico.
Utilizza
L'acido metanoico è utilizzato nelle seguenti industrie: tessile ( coloranti , trattamento della pelle ), insetticidi , lacche , solventi , concia , galvanica, fumiganti , alimentazione umana ( additivo alimentare E236). Viene anche usato per argentare gli specchi e per curare le verruche.
Viene anche utilizzato nell'apicoltura come mezzo complementare per il controllo della varroa . Viene anche utilizzato nei disincrostanti (gel da toilette).
Tracciante biologico
Durante l'avvelenamento da metanolo , quest'ultimo viene metabolizzato prima in metanale dall'azione dell'alcol deidrogenasi , un enzima non specifico che ha una migliore affinità con l' etanolo , quindi in acido formico tramite l'azione della formaldeide deidrogenasi . L'ultima fase consiste nella trasformazione in anidride carbonica , una fase che limita l'eliminazione. Quando il metanale si trasforma rapidamente, si crea un accumulo di formiato che è causa di tossicità ( acidosi metabolica ). La misurazione dei formiati nelle urine può rilevare l'avvelenamento da metanolo.
Una ricerca dell'Istituto Leibniz per la catalisi di Rostock ha dimostrato che può essere utilizzato per lo stoccaggio dell'idrogeno per alimentare una cella a combustibile .
In presenza di platino , è possibile decomporre l'acido formico in idrogeno e anidride carbonica .
CH 2 O 2 → H 2 + CO 2Nel 2006, un gruppo di ricerca dell'EPFL (Svizzera) ha presentato l'uso dell'acido formico come soluzione di stoccaggio dell'idrogeno . Un sistema catalitico omogeneo, basato su una soluzione acquosa di catalizzatori di rutenio, decompone l'acido formico HCOOH in diidrogeno H 2 e anidride carbonica CO 2 . Il diidrogeno può quindi essere prodotto in un ampio intervallo di pressione (1 - 600 bar ) e la reazione non genera monossido di carbonio . Questo sistema catalitico risolve i problemi dei catalizzatori esistenti per la decomposizione dell'acido formico (bassa stabilità, durata limitata del catalizzatore, formazione di monossido di carbonio) e rende praticabile questo metodo di stoccaggio dell'idrogeno. Il coprodotto di questa decomposizione, l'anidride carbonica, può essere utilizzato in una seconda fase per generare nuovamente acido formico mediante idrogenazione. L'idrogenazione catalitica della CO 2 è stata studiata a lungo e sono stati sviluppati metodi efficienti.
L'acido formico contiene 53 g · l -1 di idrogeno a temperatura e pressione ambiente, che è il doppio della capacità dell'idrogeno compresso a 350 bar . L'acido formico puro è un liquido infiammabile con un punto di infiammabilità di + 69 ° C , che è superiore alla benzina ( -40 ° C ) o all'etanolo (+ 13 ° C ). Diluito dall'85%, non è più infiammabile. L'acido formico diluito è persino nell'elenco degli additivi alimentari della Food and Drug Administration (FDA).
Commercio
La Francia è un importatore netto di acido formico, secondo le dogane francesi. Il prezzo medio per tonnellata importata era di 600 euro.
Rilevamento al di fuori del sistema solare
Nel 2018, l'acido metanoico è stato rilevato dal radiotelescopio ALMA nel disco protoplanetario della stella TW Hydrae .
Note e riferimenti
- ACIDO FORMICO, scheda / e di dati di sicurezza del Programma internazionale sulla sicurezza delle sostanze chimiche , consultato il 9 maggio 2009
- (en) " Methanoic acid " , su ChemIDplus , accesso 8 febbraio 2009
- (a) David R. Lide, Manuale di chimica e fisica , CRC,16 giugno 2008, 89 ° ed. , 2736 p. ( ISBN 142006679X e 978-1420066791 ) , p. 9-50
- (it) Yitzhak Marcus, Le proprietà di solventi , vol. 4, Inghilterra, John Wiley & Sons Ltd,1999, 239 p. ( ISBN 0-471-98369-1 )
- massa molecolare calcolata dal " peso atomico degli elementi 2007 " su www.chem.qmul.ac.uk .
- (in) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 ° ed. , 1076 p. ( ISBN 0387690026 , leggi online ) , p. 294
- (en) Robert H. Perry e Donald W. verde , di Perry Chemical Engineers' Handbook , Stati Uniti d'America, McGraw-Hill,1997, 7 ° ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- " Properties of Various Gases " su flexwareinc.com (accesso 12 aprile 2010 )
- (in) Carl L. Yaws, Handbook of Thermodynamic Diagrams , Vol. 1, 2 e 3, Huston, Texas, Gulf Pub. Co.,1996( ISBN 0-88415-857-8 , 978-0-88415-858-5 e 978-0-88415-859-2 )
- (a) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18 giugno 2002, 83 ° ed. , 2664 p. ( ISBN 0849304830 , presentazione online ) , p. 5-89
- (a) David R. Lide, Manuale di chimica e fisica , CRC,2008, 89 ° ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 10-205
- Scheda di dati di sicurezza pubblicata da Sigma-Aldrich, consultata il 5 settembre 2020
- " Acido formico " nel database dei prodotti chimici Reptox del CSST (organizzazione del Quebec responsabile per la sicurezza e la salute sul lavoro), accesso 24 aprile 2009
- " Formic acid " , su hazmap.nlm.nih.gov (visitato il 14 novembre 2009 )
- http://www.myrmecofourmis.fr/Jets-d-acide-formique-par-des-fourmis
- " Guarda il veleno di queste formiche soffiare bolle!" » [Video] , su YouTube (accesso 12 settembre 2020 ) .
- Codex Alimentarius, " Grade Names and International Numbering System for Food Additives " , su http://www.codexalimentarius.net ,2009(visitato il 19 maggio 2010 )
- Beekeeper68, " Treatment of Varroa with formic acid " , su http://same-apiculture.colinweb.fr/ ,18 dicembre 2010(accesso 17 agosto 2017 )
- http://www.bulletins-electroniques.com/actualites/54627.htm
- Gábor Laurenczy, Céline Fellay, Paul J. Dyson, Produzione di idrogeno dall'acido formico. PCT Int. Appl. (2008), 36 pagg. CODICE: PIXXD2 WO 2008047312 A1 20080424 AN 2008: 502691
- Céline Fellay, Paul J. Dyson, Gábor Laurenczy, Un valido sistema di stoccaggio dell'idrogeno basato sulla decomposizione selettiva di acido formico con un catalizzatore di rutenio, Angew. Chem. Int. Ed. , 2008 , 47 , 3966–3970.
- Ferenc Joó, Breakthroughs in Hydrogen Storage - Formic Acid as a Sustainable Storage Material for Hydrogen, ChemSusChem 2008 , 1 , 805–808.
- PG Jessop, in Handbook of Homogeneous Hydrogenation (a cura di: JG de Vries, CJ Elsevier), Wiley-VCH, Weinheim, Germania, 2007 , p. 489–511 .
- PG Jessop, F. Joó, C.-C. Tai, Recenti progressi nell'idrogenazione omogenea dell'anidride carbonica, Coord. Chem. Rev. , 2004 , 248, 2425–2442.
- Codice dei regolamenti federali degli Stati Uniti: 21 CFR 186.1316, 21 CFR 172.515
- " Indicatore del commercio di import / export " , sulla Direzione generale delle dogane. Indicare NC8 = 29151100 (accesso 7 agosto 2015 )
- (en) Cécile Favre, Davide Fedele, Dmitry Semenov, Sergey Parfenov et al. , " Primo rilevamento dell'acido organico più semplice in un disco protoplanetario " , The Astrophysical Journal Letters ,16 luglio 2018( leggi online ).