Anilina
| Anilina | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Struttura dell'anilina. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificazione | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome IUPAC | anilina | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinonimi |
fenilammina |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.491 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CE | 200-539-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 6115 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 17296 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SORRISI |
C1 = CC = C (C = C1) N , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1S / C6H7N / c7-6-4-2-1-3-5-6 / h1-5H, 7H2 InChIKey: PAYRUJLWNCNPSJ-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | liquido oleoso incolore con un odore caratteristico. Diventa marrone se esposto all'aria o alla luce. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà chimiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formula bruta |
C 6 H 7 N [Isomeri] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa molare | 93,1265 ± 0,0055 g / mol C 77,38%, H 7,58%, N 15,04%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 4,6 a 25 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Momento dipolare | 1,13 ± 0,02 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diametro molecolare | 0,562 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusione | −6,0 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° bollitura | 184,1 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilità |
34 g · l -1 (acqua, 20 ° C ); 3,5 parti / 100 parti (acqua, 25 ° C ); |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametro di solubilità δ |
21,1 MPa 1/2 ( 25 ° C ); 24,1 J 1/2 · cm -3/2 ( 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa volumica |
1,02 g · cm -3 , Densità del gas: 3,2 (aria = 1) equazione:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura di autoaccensione | 615 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto d'infiammabilità | 70 ° C (vaso chiuso) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limiti di esplosività in aria | 1,2 - 11 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressione del vapore saturo | a 20 ° C : 40 Pa
equazione:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viscosità dinamica | 3,71 cP a 25 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto critico | 53,1 bar , 425,85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochimica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
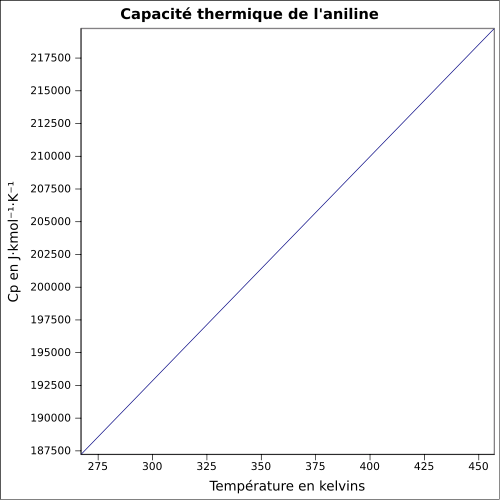
| C p |
equazione:
equazione:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PC | 3392,8 kJ · mol -1 ( 25 ° C , liquido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristallografia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classe di cristallo o gruppo spaziale | P 2 1 / c | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametri della mesh |
a = 21,822 Å b = 5,867 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume | 1053,89 Å 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà ottiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indice di rifrazione | 1.5863 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauzioni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
    Pericolo H301, H311, H317, H318, H331, H341, H351, H372, H400, H301 : Tossico se ingerito H311 : Tossico a contatto con la pelle H317 : Può provocare una reazione allergica cutanea H318 : Provoca gravi lesioni oculari H331 : Tossico se inalato H341 : Sospettato di provocare alterazioni genetiche (indicare la via di esposizione s 'è definitivamente dimostrato che nessun'altra via di esposizione porta allo stesso pericolo) H351 : Sospettato di provocare il cancro (indicare la via di esposizione se è definitivamente dimostrato che nessun'altra via di esposizione porta allo stesso pericolo) H372 : Rischio dimostrato di gravi danni agli organi ( indicare tutti gli organi interessati, se noti) a seguito di un'esposizione ripetuta o prolungata (indicare la via di esposizione se è definitivamente dimostrato che nessun'altra via di esposizione porta allo stesso pericolo) H400 : Molto tossico per gli organismi acquatici |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B3, D1A, D2B, B3 : Punto di infiammabilità del liquido combustibile = 70 ° C vaso chiuso (metodo non riportato) D1A : Materiale molto tossico con gravi effetti immediati Trasporto di merci pericolose: classe 6.1 gruppo II D2B : Materiale tossico con altri effetti tossici irritazione degli occhi negli animali; mutagenicità negli animali Divulgazione all'1,0% secondo l'elenco di divulgazione degli ingredienti |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trasporto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
60 : materiale tossico o che presenta un grado di tossicità minore Numero UN : 1547 : ANILINA Classe: 6.1 Codice di classificazione: T1 : Sostanze tossiche senza rischi sussidiari: Organici, liquidi; Etichetta: 6.1 : Materie tossiche Confezione: Gruppo di imballaggio II : sostanze moderatamente pericolose;  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classificazione IARC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo 3: non classificabile quanto alla sua cancerogenicità per l'uomo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inalazione | Capogiri, convulsioni, vomito, perdita di coscienza |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pelle | Arrossamento | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Occhi | Rossore, dolore | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ingestione | Tossico | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotossicologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 0.94 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ADI | 7 μg / kg di peso corporeo / giorno | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soglia di odore | basso: 0,58 ppm alto: 10 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unità di SI e STP se non diversamente specificato. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L' anilina , nota anche con i nomi di aminobenzene , fenilammina o benzenammina , è un composto organico aromatico di formula chimica C 6 H 5 -NH 2.
È un'ammina aromatica primaria derivata dal benzene , tossica per l'uomo e l'ambiente. Tra i suoi derivati ci sono le cloroaniline, le dicloroaniline, le tricloroaniline ...
L'anilina era nel XIX ° secolo, la base per lo sviluppo del settore colorante sintetico, raggruppati già nel Teerfarben (in francese "coloranti di catrame" . Questi derivati di anilina sono serviti per la produzione di una grande quantità di blu, viola, malva e rosso e alcuni neri, marroni e verdi.
Storico
Otto Unverdorben , distillatore di indaco , Isola nel 1826 un prodotto che chiamò krystalline . Nel 1834 Friedlieb Runge riuscì ad isolare dal catrame di carbone una sostanza che, trattata con cloruro di calce, assume un colore blu, che chiamò cianolo o cianolo .
Nel 1841, Carl Julius Fritzsche ottenne trattando l' indaco con cloruro di potassio una sostanza oleosa che designò, la prima, con il nome di anilina , dal nome latino della pianta che produce l'indaco, Indigofera anil . La parola "anil" stessa deriva dai termini sanscriti nila , blu profondo e pianta indaco nila . Più o meno nello stesso periodo, Nikolai zinine scoprì che la riduzione del nitrobenzene fornisce una base che chiamò benzidam .
August Wilhelm von Hofmann ha dimostrato nel 1855 che queste sostanze sono identiche.
Nel 1856 William Henry Perkin , un giovane allievo di Hofmann, stava cercando un modo per sintetizzare il chinino . Non ci riuscì, ma all'età di diciotto anni sviluppò il primo colorante viola a base di anilina, il mauveine , che portò al primo utilizzo dell'anilina su scala industriale.
In Germania, la produzione di "color carbone" o "catrame" o "carbone" (in tedesco Teerfarben ) ha lanciato una grande industria il cui nome è associato all'anilina: Badische Anilin- & Soda-Fabrik ( BASF ).
Proprietà fisico-chimiche
In condizioni normali , l'anilina è un liquido oleoso incolore, con un odore sgradevole e facilmente infiammabile. Si ossida lentamente a contatto con l'aria, formando una resina rosso bruno.
L'anilina è una base debole . La delocalizzazione del doppietto non legante dell'atomo di azoto sull'anello aromatico fa sì che la forma protonata di anilina sia meno favorita rispetto al caso delle ammine alifatiche (più basiche). Reagisce con acidi forti formando sali contenenti lo ione anilinio (C 6 H 5 –NH 3+ ). Reagisce anche con gli alogenuri acilici (es . Cloruro di etanoile ) formando ammidi . Le ammidi formate dall'anilina sono talvolta chiamate anilidi , come l' acetanilide .
L'anilina, come tutte le ammine, è facilmente ossidabile. La sua ossidazione è catalizzata dalla luce, dal calore e dalle impurità metalliche e consente la formazione di azobenzene , un composto azoico colorato. Una volta ossidata, l'anilina assume un colore marrone. Questa reazione richiede che l'anilina venga conservata in bottiglie marroni, eventualmente sotto azoto, in un luogo fresco e in presenza di chelanti e antiossidanti.
L'anilina reagisce con l' alogenuro ad alchile formando ammine secondarie o terziarie. L' acido cromico aiuta a trasformarlo in chinone . Reagisce con ioni clorato in presenza di sali metallici (soprattutto vanadio ), formando anilina nera . Reagisce con acido cloridrico e clorato di potassio formando cloranile. L' ossidazione da parte del prodotto di permanganato di potassio nitrobenzene è neutra, l' azobenzene , dell'ammoniaca e dell'acido ossalico in mezzo basico e l' anilina nera in mezzo acido. Reagisce con l'acido ipocloroso formando para-ammino fenolo e para-ammino difenilammina.
Come il benzene o il fenolo , l'anilina è reattiva per sostituzione aromatica elettrofila . Ad esempio, esso può subire solfonazione per formare l' acido solfonico che può essere convertito in sulfamidici ( farmaci ampiamente utilizzati nei primi XX ° secolo come antisettico ).
L'anilina reagisce con l'acido nitroso per formare sali di diazonio . Attraverso di loro, il gruppo amminico può essere trasformato semplicemente in un gruppo idrossi , ciano o alogenuro .
Utilizza
Il suo originario interesse commerciale deriva dalla sua capacità di tingere con una buona resa. La scoperta del mauveine da parte di William Henry Perkin nel 1858 diede inizio alla scoperta di un gran numero di coloranti che presto si contarono a centinaia. Dal terzo quarto del XIX ° secolo ai primi due del XX ° secolo , il termine "coloranti all'anilina" significava per estensione tutte sostanze coloranti organiche e inchiostri liquidi che tinto ( GRP 1 ).
Oltre alle tinture, l'anilina è stata il materiale di partenza per la sintesi di un gran numero di farmaci .
Fino all'arrivo della penna a sfera , le matite all'anilina hanno avuto un grande successo. Nonostante la tossicità, bagniamo la punta della punta della lingua per ottenere una linea blu intensa e indelebile. L' inchiostro all'anilina è stato utilizzato anche nel contesto della riproduzione meccanica di documenti (detto metodo di stampa transfer ).
Attualmente, l'uso più significativo dell'anilina è nella produzione di 4,4'-MDI , che utilizza circa l'85% dell'anilina prodotta. Altri usi includono la produzione chimica di gomma (9%), erbicidi (2%) e pigmenti o coloranti (2%).
Test di Schaeffer
Utilizzato come reagente chimico nella determinazione di alcuni funghi. Consiste nel tracciare una linea con acido nitrico concentrato (68%) poi una perpendicolare con l'anilina. Il test è positivo se appare un colore arancione all'incrocio “ Schaeffer ” , al Cercle des mycologues du Luxembourg belge .
Produzione
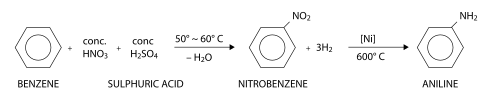
L'anilina può essere prodotta dal benzene in due fasi. Nella prima fase, il benzene subisce la nitrazione ( sostituzione aromatica elettrofila mediante acido nitrico ) per formare nitrobenzene . Nella seconda fase, il nitrobenzene viene ridotto per formare l'anilina. Un'ampia varietà di reagenti riducenti può essere utilizzata durante questa seconda fase, incluso in particolare idrogeno (in presenza di un catalizzatore ), idrogeno solforato o metalli come ferro , zinco o stagno .
Tossicità e sicurezza
L'anilina, che è molto tossica, deve essere maneggiata con cura. La classificazione CEE (etichettatura regolamentare di sostanze e preparati pericolosi) lo classificava come "molto tossico per gli organismi acquatici e pericoloso per l'ambiente".
L'esposizione ad alte concentrazioni può essere fatale. Può essere assorbito per inalazione , ingestione e contatto con la pelle, anche sotto forma di vapore . Riscaldata a oltre 190 ° C , si decompone producendo fumi tossici (contenenti in particolare ammoniaca ).
Alcune organizzazioni elencano l'anilina come cancerogeno . Tuttavia, l' Agenzia internazionale per la ricerca sul cancro lo classifica nell'elenco 3 ("impossibile classificarlo per quanto riguarda la cancerogenicità per l'uomo"), i dati disponibili sono contraddittori e in numero insufficiente.
La dose letale 50 è stata stimata essere 250 mg · kg -1 per via orale nei ratti.
Il valore del limite di esposizione professionale in Francia è di 2 ppm o 10 mg · m -3 .
Controverso
Studi epidemiologici Hanno collegato miscele di oli contenenti olio di colza denaturato e anilina con l'epidemia di " sindrome da olio tossico " che ha colpito la Spagna nel 1981 e ha causato circa 20.000 malattie gravi, provocando 12.000 ricoveri e oltre 350 morti. L' eziologia di questa sindrome rimane sconosciuta.
Vedi anche
Bibliografia
- Jean Petit , Jacques Roire e Henri Valot , Enciclopedia della pittura: formulare, produrre, applicare , t. 1, Puteaux, EREC,1999, p. 195 "Anilina (colori di ...)"
Articoli Correlati
link esterno
Note e riferimenti
- ANILINA , schede di dati di sicurezza del Programma internazionale sulla sicurezza delle sostanze chimiche , consultato il 9 maggio 2009
- " anilina " su nih.gov (accessibile il 1 ° settembre 2020 ) .
- (a) David R. Lide, Manuale di chimica e fisica , Boca Raton, CRC,16 giugno 2008, 89 ° ed. , 2736 p. ( ISBN 978-1-4200-6679-1 , avviso BnF n o FRBNF41361395 ) , p. 9-50
- (a) Yitzhak Marcus, Le proprietà di solventi , vol. 4, Inghilterra, John Wiley & Sons Ltd,1999, 239 p. ( ISBN 978-0-471-98369-9 , LCCN 98018212 )
- massa molecolare calcolata dal " peso atomico degli elementi 2007 " su www.chem.qmul.ac.uk .
- "Aniline" in Hazardous Substances Data Bank , consultato il 16 luglio 2012
- (in) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 ° ed. , 1076 p. ( ISBN 978-0-387-69002-5 , presentazione online ) , p. 294
- (en) Robert H. Perry e Donald W. verde , di Perry Chemical Engineers' Handbook , Stati Uniti d'America, McGraw-Hill ,1997, 7 ° ed. , 2400 p. ( ISBN 978-0-07-049841-9 , LCCN 96051648 ) , p. 2-50
- " Properties of Various Gases " su flexwareinc.com (accesso 12 aprile 2010 )
- (in) Carl L. Yaws, Manuale di diagrammi termodinamici: composti organici da C5 a C7 , vol. 2, Huston, Texas, Gulf Pub. Co.,1996, 400 p. ( ISBN 978-0-88415-858-5 , LCCN 96036328 )
- (a) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18 giugno 2002, 83 ° ed. , 2664 p. ( ISBN 0849304830 , presentazione online ) , p. 5-89
- " Aniline " , su www.reciprocalnet.org (visitato il 12 dicembre 2009 )
- Gruppo di lavoro IARC sulla valutazione dei rischi cancerogeni per l'uomo, " Evaluations Globales de la Carcinogenicité pour l'Homme, Groupe 3: Unclassables as to their cancerogenicity to Humans " , su http://monographs.iarc.fr , IARC,16 gennaio 2009(visitato il 22 agosto 2009 )
- Numero indice nella tabella 3.1 dell'appendice VI del regolamento CE N ° 1272/2008 (16 dicembre 2008)
- " Anilina " nel database delle sostanze chimiche Reptox del CSST (organizzazione del Quebec responsabile per la sicurezza e la salute sul lavoro), accesso 23 aprile 2009
- Concentrazioni / assunzioni giornaliere accettabili e concentrazioni / dosi tumorigeniche di sostanze prioritarie calcolate secondo criteri sanitari , pubblicate da Health Canada
- " Anilina, " a hazmap.nlm.nih.gov (accesso 14 Nov 2009 )
- Philip Ball ( traduzione Jacques Bonnet), Living History of Colors: 5000 Years of Painting Told by Pigments [" Bright Earth: The Invention of Color "], Parigi, Hazan,2010, p. 305mq ; Rodolphe Radau , " I nuovi colori derivati dal catrame di carbone ", Revue des Deux Mondes ,1874, p. 899 ( leggi in linea ).
- " AMINES ET DERIVES " , on pharmtox.free.fr (visitato il 14 giugno 2016 )
- Secondo " Fiches de sécurité " , su Scienze fisiche e chimiche, Académie de Nancy-Metz .
(en) "Aniline", in Encyclopædia Britannica , 1911 [ ![]() (en) Leggi online su Wikisource ]
(en) Leggi online su Wikisource ]