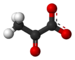
Acido piruvico
| Acido piruvico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Struttura dell'acido piruvico |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificazione | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome IUPAC | Acido 2-ossopropanoico | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinonimi |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.004.387 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CE | 204-824-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 1060 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2970 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SORRISI |
CC (= O) C (= O) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
Std. InChI: InChI = 1S / C3H4O3 / c1-2 (4) 3 (5) 6 / h1H3, (H, 5,6) Std. InChIKey: LCTONWCANYUPML-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | liquido incolore | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà chimiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formula bruta |
C 3 H 4 O 3 [Isomeri] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa molare | 88,0621 ± 0,0036 g / mol C 40,92%, H 4,58%, O 54,5%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 2.4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusione | 12 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° bollitura | 165 ° C (decomposizione) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilità | solubile in etanolo ed etere | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscibilità | miscibile in acqua | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa volumica | 1,27 g · cm da -3 a 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto d'infiammabilità | 82 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochimica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
equazione:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauzioni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Pericolo H314, P280, P301 + P330 + P331, P305 + P351 + P338 , P309 + P310, H314 : Provoca gravi ustioni cutanee e gravi lesioni oculari P280 : Indossare guanti / indumenti protettivi / Proteggere gli occhi / il viso. P301 + P330 + P331 : In caso di ingestione: sciacquare la bocca. Non provoca il vomito. P305 + P351 + P338 : In caso di contatto con gli occhi: sciacquare accuratamente per parecchi minuti. Rimuovere le lenti a contatto se la vittima le indossa e possono essere rimosse facilmente. Continua a risciacquare. P309 + P311 : In caso di esposizione o di malessere: contattare immediatamente un CENTRO ANTIVELENI o un medico. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B3, E, B3 : Punto di infiammabilità del liquido combustibile = 83,8 ° C vaso chiuso Metodo Setaflash E : Materiale fortemente corrosivo acido (pH calcolato = 1,8 per una soluzione 0,1 M) Divulgazione all'1,0% secondo i criteri di classificazione |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trasporto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
80 : corrosivo o con un grado di corrosività minore Numero UN : 3265 : LIQUIDO CORROSIVO, ACIDO, ORGANICO, NSA Classe: 8 Etichetta: 8 : Materie corrosive Confezione: Gruppo di imballaggio III : sostanze a basso pericolo.  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotossicologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | topo, sottocutaneo: 3533 mg · kg -1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Composti correlati | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altri composti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unità di SI e STP se non diversamente specificato. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L' acido piruvico è un composto chimico di formula CH 3 -CO-COOH. È un 2-osso acido o α- chetoacido , che svolge sia una funzione acido carbossilico che una funzione chetone . La sua base coniugata è l' anione piruvato CH 3 -CO-COO -, Una chiave metabolita trova all'incrocio di diversi importanti vie metaboliche in cellule viventi , come glicolisi , il ciclo di Krebs e la gluconeogenesi , e può essere convertito in acido grasso , alanina o etanolo dopo decarbossilazione ossidativa in acetil-coenzima A .
Acido piruvico
L'acido piruvico si presenta come un liquido incolore, simile nell'odore all'acido acetico . È miscibile in acqua e solubile in etanolo ed etere .
In laboratorio, l'acido piruvico può essere preparato riscaldando una miscela di acido tartarico e bisolfato di potassio , mediante ossidazione del glicole propilenico da parte di un forte agente ossidante (ad esempio, permanganato di potassio o ipoclorito di sodio ), o ancora mediante idrolisi di 2- ossopropiononitrile , formato dalla reazione di etanoil cloruro con cianuro di potassio :
CH 3 COCl + KCN → CH 3 COCN CH 3 COCN → CH 3 COCOOHBiochimica del piruvato
Descrizione
Lo ione piruvato è il prodotto finale delle vie di degradazione del glucosio ( glicolisi , via del pentoso fosfato , via Entner-Doudoroff ). È il substrato di una fermentazione nella condizione anaerobica (fermentazione lattica), e il ciclo di Krebs è fornito indirettamente dall'aerobica dopo la decarbossilazione ossidativa convertendolo in acetil-CoA .
Formazione di piruvato mediante glicolisi

|
+ ADP + H + ATP + |

|
| PEP | Acido piruvico | |
| Piruvato chinasi - EC | ||
Il fosfoenolpiruvato (PEP) formato durante la glicolisi ha un gruppo fosfato con un alto potenziale di trasferimento - ΔG ° ' = −61,9 kJ mol −1 , il valore più alto misurato negli esseri viventi - che consente la fosforilazione di una molecola di ADP in ATP da parte del piruvato chinasi . Per questa reazione è necessario un catione Mg 2+ come cofattore .
Destino del piruvato nell'anaerobiosi
Le seguenti reazioni avvengono, in mezzo anaerobico , nel citoplasma , nel muscolo , nei batteri lattici (per la fermentazione dell'acido lattico , ad esempio nel lactobacillus ), o anche nel lievito (per la fermentazione alcolica ). Sono possibili altre fermentazioni , ad esempio nelle Enterobacteriaceae (cfr. Vie di fermentazione delle Enterobacteriaceae ).
Fermentazione lattica

|
+ NADH + H + → NAD + + |

|
| Acido piruvico | Acido lattico | |
| L - deidrogenasi - EC | ||
CH 3 -CHOH-COO - lattatoprodotto nel muscolo non è responsabile della rigidità , contrariamente a quanto si crede, e non interviene nel fenomeno dei crampi . Inoltre, può essere trasportato nel sangue e quindi nelle cellule del fegato ( ciclo di Cory ).
Fermentazione alcolica- CH 3 -CO-COO -+ H + → CH 3 CHO+ CO 2, dalla piruvato decarbossilasi , in presenza di tiamina pirofosfato (TPP).
- CH 3 CHO+ NADH + H + CH 3 CH 2 OH + NAD + , mediante alcol deidrogenasi .
Destino del piruvato nell'aerobiosi
In un ambiente aerobico , il piruvato viene degradato nei mitocondri . Entra attraverso il trasloco piruvato . Sono possibili due reazioni che generano i precursori del ciclo di Krebs :
Decarbossilazione ossidativa ad acetil-CoAQuesta reazione è catalizzata da un complesso multienzimatico, il complesso piruvato deidrogenasi , che coinvolge cinque coenzimi :
- tre coenzimi legati agli apoenzimi : TPP , lipoato e FAD (questi sono gruppi protesici );

|
+ NAD + + CoA-SH → CO 2+ NADH + H + + |
|
| Acido piruvico | Acetil-CoA | |
|
Complesso piruvato deidrogenasi : piruvato deidrogenasi (E1) - EC diidrolipoamide S-acetiltransferasi (E2) - EC diidrolipoil deidrogenasi (E3) - EC | ||
Questa reazione avviene a livello della parete mitocondriale per gli eucarioti ea livello della membrana per i procarioti .
Il NADH + H + sarà successivamente riossidato dalla catena respiratoria , sinonimo di catena di trasporto degli elettroni mitocondriali, per generare l' ATP aerobicamente.
Carbossilazione in ossalacetatoLa reazione, catalizzata in presenza di biotina dalla piruvato carbossilasi ( sintetasi ), produce ossalacetato :

|
+ ATP + CO 2 → ADP + Pi + |
|
| Acido piruvico | Acido ossalacetico | |
| Piruvato carbossilasi - EC | ||
Questa è una delle principali reazioni anaplerotiche .
Efficienza energetica comparativa
Da una molecola di glucosio , che dà due molecole di piruvato:
- le fermentazioni hanno una resa mediocre: rilasciano solo due molecole di ATP per molecola di glucosio;
- le degradazioni aerobiche sono molto più redditizie: ogni molecola di glucosio consente la produzione di 14 molecole di ATP tramite decarbossilazione ossidativa, o 6 molecole di ATP tramite carbossilazione, anche prima della degradazione dell'acetil-CoA da parte del ciclo di Krebs che rilascia ancora più energia.
Note e riferimenti
- massa molecolare calcolata dal " peso atomico degli elementi 2007 " su www.chem.qmul.ac.uk .
- Inserimento del numero CAS "127-17-3" nella banca dati chimica GESTIS dell'IFA (ente tedesco responsabile della sicurezza e salute sul lavoro) ( tedesco , inglese ), accesso 03/08/09 (JavaScript necessario)
- (in) Carl L. Yaws, Handbook of Thermodynamic Diagrams , Vol. 1, Huston, Texas, Gulf Pub. Co.,1996( ISBN 0-88415-857-8 )
- "L'acido piruvico" voce nel database chimica GESTIS dell'IFA (ente tedesco responsabile per la sicurezza sul lavoro e la salute) ( tedesco , inglese ), si accede 6 Gennaio, 2019 (È necessario JavaScript)
- " Acido piruvico " nel database delle sostanze chimiche Reptox del CSST (organizzazione del Quebec responsabile per la sicurezza e la salute sul lavoro), accesso 24 aprile 2009
- Sintesi organiche, Coll. Volo. 1, p. 475 (1941); Volo. 4, p. 63 (1925). [1]
- Wienek, Biologia dello sport , p. 256, Vigot