Lattato deidrogenasi
lattato deidrogenasi Struttura della lattato deidrogenasi muscolare che mostra le quattro subunità
Struttura della lattato deidrogenasi muscolare che mostra le quattro subunità
| CE n. | CE |
|---|---|
| numero CAS |
| IUBMB | Voce IUBMB |
|---|---|
| IntEnz | Vista IntEnz |
| BRENDA | Ingresso BRENDA |
| KEGG | Ingresso KEGG |
| MetaCyc | Passaggio metabolico |
| PRIAM | Profilo |
| PDB | Strutture |
| PARTIRE | AmiGO / EGO |
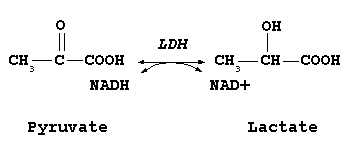
La lattato deidrogenasi ( LDH ) o lattico deidrogenasi sono enzimi presenti in un'ampia diversità di organismi, sia vegetali che animali. Catalizzano la conversione del piruvato in lattato e viceversa. Esistono diversi tipi di questi enzimi, che differiscono a seconda della natura del cofattore della reazione e dello stereoisomero del lattato formato. Il lattato ha infatti due isomeri D e L e ci sono lattato deidrogenasi in grado di formare l'uno o l'altro dei prodotti.
Il cofattore più comune delle lattato deidrogenasi è l' NADH che viene convertito in NAD + . Questa conversione è la reazione di base della fermentazione lattica che permette di rigenerare il NAD + al termine della glicolisi. È coinvolto in un gran numero di biotrasformazioni da parte di microrganismi e batteri lattici. Alcuni lattato deidrogenasi possono anche utilizzare NADPH , o anche altri cofattori come il citocromo c .
Nei mammiferi si trova solo la lattato deidrogenasi NADH che produce L-lattato ( EC 1.1.1.27 ). È anche in grado di catalizzare l'ossidazione del 2-idrossibutirrato ed è quindi occasionalmente indicato anche come idrossibutirrato deidrogenasi ( HBD ).
Questo articolo si concentra sulle lattato deidrogenasi di quest'ultima famiglia (EC 1.1.1.27)
Isoenzimi
NADH L-lattato deidrogenasi è un enzima tetramerica. Nei mammiferi, ogni subunità può essere sia di Tipo H (inglese h eart = cuore ) che M ( m uscle ) (in base al loro comportamento elettroforetico .) A seconda del tipo di articolazione formata devono quindi cinque isotipi di LDH:
- LDH-1 (4H) - principalmente nel cuore
- LDH-2 (3H1M) - principalmente nel sistema reticoloendoteliale
- LDH-3 (2H2M) - principalmente nei polmoni
- LDH-4 (1H3M) - principalmente nei reni
- LDH-5 (4M) - principalmente nel fegato e nei muscoli scheletrici
In generale, la forma predominante nel siero è LDH-2. Un livello di LDH-1 più alto di LDH-2 suggerisce un infarto del miocardio (danno al tessuto cardiaco che rilascia LDH cardiaco, che è ricco di LDH-1, nel flusso sanguigno). Tuttavia, la diagnosi di infarto sulla base di questo fenomeno è stata ampiamente superata misurando i livelli di troponina I o T.
Genetica umana
Le subunità H e M sono codificate da due geni differenti:
- La subunità è codificata da M LDHA , che si trova sul cromosoma 11p15.4 ( (in) 150000 )
- La subunità H è codificata da LDHB , che si trova sul cromosoma 12p12.2-p12.1 ( (en) 150100 )
Mutazioni
- Le mutazioni nella subunità M sono state correlate a una malattia rara, la mioglobinuria da stress (vedi articolo OMIM )
- Sono state descritte alcune mutazioni della subunità H ma non sembrano causare la malattia.
Aspetti medici
Emolisi
In medicina , l'LDH è spesso usato come marker per i danni ai tessuti. Poiché LDH è abbondante nei globuli rossi , può fungere da marker per l' emolisi . Un campione di sangue che è stato elaborato in modo errato può avere attività LDH elevate di falsi positivi a causa di danni agli eritrociti .
Turnover tissutale
Altre applicazioni del test di attività LDH riguardano la distruzione dei tessuti in generale; questo è possibile se non ci sono altri segni di emolisi . Viene utilizzato per il monitoraggio dei malati di cancro (soprattutto nei casi di linfoma o cancro ai testicoli ): poiché le cellule tumorali si rinnovano rapidamente, la loro distruzione porta ad un alto livello di LDH.
Valore normale
- Valore normale della concentrazione plasmatica di LDH: 190-390 UI / L
- 125-220 U / L in analisi del sangue (piruvato 37 ° C ABBOTT test)