Picolina
La picolina o metilpiridina è un eterociclico aromatico di formula empirica C 6 H 7 N. E' costituita da un nucleo piridina sostituito da metile , ed è sotto forma di tre isomeri a seconda della posizione relativa del gruppo metilico nel ciclo rispetto a l'atomo di azoto .
Proprietà
| Picolina | |||
| Nome | 2-metilpiridina | 3-metilpiridina | 4-Metilpiridina |
| Altri nomi | 2-picolina α-picolina o -picoline orto picolina |
3-Picolin β- Picolin m -picolin meta picolina |
4-picolina γ-picolina p -picoline para picolina |
| Formula strutturale |

|

|
|
| numero CAS | |||
| (miscela) | |||
| PubChem | 7975 | 7970 | 7962 |
| formula bruta | C 6 H 7 N | ||
| Massa molare | 93,13 g mol −1 | ||
| Stato ( CNTP ) | liquido | ||
| Aspetto | liquido incolore odore sgradevole e acre |
liquido da incolore a giallastro |
odore di piridina liquida giallastra |
| Punto di fusione | −70 °C | −18 °C | 3 °C |
| Punto di ebollizione | 128 °C | 144 °C | 145 °C |
| Densità ( 20 ° C ) | 0,94 g · cm -3 | 0,96 g · cm -3 | 0,96 g · cm -3 |
|
Pressione di vapore saturante ( 20 ° C ) |
12 hPa | 5,9 hPa | 5,8 hPa |
| punto d'infiammabilità | 27 °C (vaso chiuso) | 36 °C (vaso chiuso) | 39 °C (vaso chiuso) |
| Punto di autoaccensione | 535 °C | > 500 °C | |
| Limiti esplosivi | 1,4-8,6 vol.% 54-330 g/m³ |
1,3-8,7 vol.% 55-335 g/m³ |
1,3-8,7 vol.% 50-335 g/m³ |
| Solubilità in acqua | solubile | ||
|
pK A (da acido coniugato BH + ) |
5.94 | 5.63 | 6.03 |
| LogP | 1.11 | 1.2 | 1.22 |
| SGH |
 
Pericolo |
||
| Frasi H e P |
H226 , H302 e H311
H226 : Liquido e vapori infiammabili H302 : Nocivo per ingestione H311 : Tossico a contatto con la pelle H319 , H332 e H335 H319 : Provoca grave irritazione oculare H332 : Nocivo se inalato H335 : Può irritare le vie respiratorie |
H226 , H302 e H311
H226 : Liquido e vapori infiammabili H302 : Nocivo per ingestione H311 : Tossico a contatto con la pelle H314 e H332 H314 : Provoca gravi ustioni cutanee e gravi lesioni oculari H332 : Nocivo per inalazione |
H226 , H311 e H302 + H332
H226 : Liquido e vapori infiammabili H311 : Tossico a contatto con la pelle H302 + H332 : Nocivo se ingerito o inalato. H315 , H319 e H335 H315 : Provoca irritazione cutanea H319 : Provoca grave irritazione oculare H335 : Può irritare le vie respiratorie |
|
P261 e P280.3
P261 : Evitare di respirare la polvere/i fumi/i gas/la nebbia/i vapori/gli aerosol. P280.3 : Indossare protezioni per gli occhi. P312 e P305 + P351 + P338 P312 : chiamare un CENTRO ANTIVELENI o un medico/medico se non si sente bene. P305 + P351 + P338 : In caso di contatto con gli occhi: sciacquare accuratamente con acqua per diversi minuti. Rimuovere le lenti a contatto se la vittima le indossa e possono essere facilmente rimosse. Continua a sciacquare. |
- |
P210 , P280 e P302 + P352
P210 : Tenere lontano da fonti di calore/scintille/fiamme libere/superfici calde. - Vietato fumare. P280 : Indossare guanti/indumenti protettivi/proteggere gli occhi/proteggere il viso. P302 + P352 : In caso di contatto con la pelle: lavare abbondantemente con acqua e sapone. P305 + P351 + P338 e P308 + P310 P305 + P351 + P338 : In caso di contatto con gli occhi: sciacquare accuratamente con acqua per diversi minuti. Rimuovere le lenti a contatto se la vittima le indossa e possono essere facilmente rimosse. Continua a sciacquare. P308 + P310 : In caso di esposizione accertata o sospetta: chiamare un CENTRO ANTIVELENI o un medico. |
|
Le picoline sono liquidi incolori che hanno un odore simile alla piridina . Sono miscibili con acqua, etanolo ed etere etilico . I tre isomeri hanno punti di fusione molto distanti, rispettivamente -70, -18 e 3 °C , ma punti di ebollizione relativamente vicini.
Come in 2- e 4-picoline, i gruppi metilici sono direttamente coniugati all'atomo di azoto che assorbe gli elettroni, i gruppi metilici di questi due isomeri possono essere deprotonati relativamente facilmente da basi forti come la litio diisopropilammide o il butillitio , quindi sostituiti.
Sintesi
Oggigiorno, la 2-picolina viene prodotta principalmente per due vie sintetiche: la condensazione di acetaldeide o formaldeide e ammoniaca , oppure per ciclizzazione di nitrili e acetilene ( ciclizzazione di Bönnemann ). Di seguito è riportato l'esempio della reazione tra acetaldeide e ammoniaca:

Circa 8.000 toni sono stati prodotti in tutto il mondo nel 1989.
La 3-metilpiridina può essere preparata facendo reagire l' acroleina con l'ammoniaca:
ma il metodo più efficiente utilizza acroleina, propanale e ammoniaca:
Circa 9.000 toni sono stati prodotti in tutto il mondo nel 1989.
Utilizzo
Tutti e tre gli isomeri hanno proprietà abbastanza simili alla piridina nelle loro proprietà e possono facilmente sostituirla in applicazioni in cui l'esatta struttura molecolare non è importante, ad esempio come solventi . In caso contrario, servono come base sintetica per prodotti farmaceutici e agrochimici e per la produzione di coloranti .
Si possono citare , ad esempio, la 2-vinilpiridina e la nitrapirina , un prodotto agrochimico, che può essere ottenuto dalla 2-picolina. La 3-picolina può essere utilizzata come materia prima per la sintesi di clorpirifos e niacina e la 4-picolina viene utilizzata per produrre l'agente antitubercolare isoniazide .
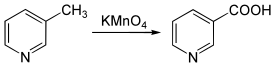
L'ossidazione delle picoline, ad esempio mediante permanganato di potassio (KMnO 4 ), produce gli acidi carbossilici equivalenti, rispettivamente l' acido picolinico , l' acido nicotinico e l'acido isonicotinico .

Ambiente
Le picoline sono più volatili e si degradano più lentamente delle loro controparti di acido carbossilico. La volatilizzazione è molto minore nel suolo che nell'acqua, a causa dell'assorbimento di composti sulle argille del suolo e sulla materia organica. La degradazione delle picoline sembra essere principalmente mediata dai batteri, la maggior parte degli isolati appartenenti ad actinobatteri . La 3-metilpiridina si degrada più lentamente degli altri due isomeri, probabilmente a causa dell'impatto della risonanza nell'anello eterociclico. Come la maggior parte dei derivati piridinici semplici, le picoline contengono più azoto del necessario per la crescita dei microrganismi e l'azoto in eccesso viene solitamente espulso nell'ambiente sotto forma di ammonio durante il processo di degradazione.
Storia
La picolina fu isolata per la prima volta, in forma impura, nel 1826 dal chimico tedesco Otto Unverdorben (1806 - 1873), che la ottenne per pirolisi delle ossa e la chiamò “ Odorin ” per il suo odore sgradevole. Nel 1849, il chimico scozzese Thomas Anderson (1819 - 1874) preparò la picolina pura dal catrame di carbone e dalla pirolisi dell'osso. Anderson poi lo chiama "picoline" da una combinazione delle parole latine pix (catrame) e oleum (olio), essendo l'olio di catrame di carbone il materiale da cui lo aveva estratto. Intorno al 1870, il chimico tedesco Adolf von Baeyer sintetizzò la picolina in due modi: mediante distillazione a secco di " acroleïnammoniak " (CH 2 = CH-CH = N-CHOH-CH = CH 2 ), e riscaldando " tribromallyl " ( 1,2 ,3-tribromopropano ) con ammoniaca in etanolo .
Nel 1871, il chimico e fisico inglese James Dewar ipotizzò che la picolina fosse metilpiridina. Tuttavia, se la struttura della piridina proposta dal chimico garmano-italiano Wilhelm Körner nel 1869 è corretta, vale a dire che la piridina è un analogo del benzene (un anello esagonale con legami singoli e doppi alternati), ciò significa che esistono tre isomeri della metilpiridina. Intorno al 1879, il chimico austriaco Hugo Weidel riuscì ad isolare e caratterizzare tre isomeri della picolina, che chiamò α–, β– e γ – picolina, essendo α – picolina il componente principale della picolina impura, accompagnata da piccole quantità di β – picolin, e γ – picolin ottenibile mediante distillazione Baeyer a secco di acroleinammoniak .
Weidel poi sottopone ciascun isomero della picolina ad ossidazione mediante permanganato di potassio , trasformandolo in acido carbossilico . Quindi chiama la forma acida di α – picolin Picolinsäure ( acido picolinico ). Riconobbe nella forma acida di β – picolin Nicotinsäure ( niacina o acido nicotinico), un composto che aveva scoperto nel 1873.
Quando Weidel decarbossila la forma di acido carbossilico di ciascun isomero - per distillazione a secco del loro sale di calcio con ossido di calcio - ottiene la piridina, dimostrando così che la picolina era una miscela dei tre isomeri della metilpiridina, come sperava. Tuttavia, Weidel non determinò mai per nessuno degli isomeri la posizione del gruppo metilico rispetto all'atomo di azoto dell'anello piridico.La struttura della niacina, e quindi quella della β-picolina, fu determinata nel 1883 quando il chimico ceco-autico Zdenko Skraup e Albert Cobenzl hanno ossidato ripetutamente la β – naftochinolina e hanno trovato la niacina tra i prodotti, dimostrando così che la β – picolina era 3-metilpiridina.
Note e riferimenti
- (en) / (de) Questo articolo è parzialmente o interamente tratto da articoli intitolati in inglese " Picoline " ( vedi elenco autori ) e in tedesco " Picoline " ( vedi elenco autori ) .
- Voce "2-Picoline" nel database chimico GESTIS dell'IFA (ente tedesco responsabile per la sicurezza e la salute sul lavoro) ( tedesco , inglese ), accesso 02/01/2021 (JavaScript richiesto) .
- Voce "2-Picoline" nel database chimico GESTIS dell'IFA (organismo tedesco responsabile per la sicurezza e la salute sul lavoro) ( tedesco , inglese ), accesso 02/01/2021 ( JavaScript richiesto) .
- Voce "4-Picoline" nel database chimico GESTIS dell'IFA (ente tedesco responsabile per la sicurezza e la salute sul lavoro) ( tedesco , inglese ), accesso 02/01/2021 (JavaScript richiesto) .
- CRC Handbook delle tabelle per il composto organico di identificazione , 3 e ed. , 1984 ( ISBN 0-8493-0303-6 ) .
- (de) metilpiridina ingresso sul RÖMPP online . Georg Thieme Verlag, consultato il 25 novembre 2014.
- M. Sainsbury, M. Berry, JD Hepworth, C. Drayton, EW Abel, D Phillips, JD Woollins, AG Davies, Chimica eterociclica , Royal Society of Chemistry,2009, 1 ° ed. ( ISBN 0-85404-652-6 ) , pag. 30
- (en) Shinkichi Shimizu , Nanao Watanabe , Toshiaki Kataoka , Takayuki Shoji , Nobuyuki Abe , Sinji Morishita e Hisao Ichimura , Ullmann's Encyclopedia of Industrial Chemistry , Weinheim, Wiley-VCH, 2005( DOI 10.1002 / 14356007.a22_399 ).
- (de) A. Behr, Angewandte homogene Katalyse , Weinheim, Wiley-VCH,2008( ISBN 3-527-31666-3 ) , pag. 722
- (in) Eric Scriven e FV Ramiah Murugan, Kirk-Othmer Encyclopedia of Chemical Technology , XLI,2005( DOI 10.1002 / 0471238961.1625180919031809.a01.pub2 ) , "Piridina e derivati piridinici".
- GK Sims e LE Sommers , “ Degradazione dei derivati piridinici nel suolo ”, J. Environmental Quality , vol. 14, n . 4,1985, pag. 580–584 ( DOI 10.2134 / jeq1985.00472425000140040022x )
- GK Sims e LE Sommers , " Biodegradazione dei derivati piridinici nelle sospensioni del suolo " , Tossicologia ambientale e chimica , vol. 5, n . 6,1986, pag. 503-509 ( DOI 10.1002 / ecc.5620050601 )
-
Per la storia delle prime ricerche sulla picolina, vedere:
- Manuale di chimica , vol. volo. 11, Londra, Inghilterra, Società Cavendish,1857, 263–272 p. ( leggi in linea )
- (de) Neues Handwörterbuch der Chemie [“Nuovo dizionario di chimica”], vol. volo. 5, Braunschweig, Germania, Friedrich Vieweg und Sohn,1890, 575-584 p. ( leggi in linea )
- (de) Arthur Calm e Karl Buchka , Die Chemie des Pyridins und seiner Derivate [“La chimica della piridina e dei suoi derivati”], Braunschweig, Germania, Friedrich Wieweg und Sohn, 1889–1891, 62–68 p. ( leggi in linea )
- (de) Richard Wolffenstein , Die Pflanzenalkaloide [“Gli alcaloidi vegetali”], Berlino, Germania, Julius Springer,1922, 40-42 p. ( ISBN 9783642924491 , leggi online )
- (de) Otto Unverdorben , “ Ueber das Verhalten der organischen Körper in höheren Temperaturen ” [“Sul comportamento delle sostanze organiche alle alte temperature”], Annalen der Physik und Chemie , vol. 8,1826, pag. 253-265; 477–487 ( leggi in linea ) Unverdorben chiamato picoline Odorin a p. 255.
- Thomas Anderson , “ Sulla costituzione e le proprietà della picolina, una nuova base organica dal catrame di carbone ”, Transactions of the Royal Society of Edinburgh , vol. 16, n . 21849, pag. 123–136 ( DOI 10.1017 / S0080456800024984 , leggi online )
- Thomas Anderson , “ Sui prodotti della distillazione distruttiva di sostanze animali. Parte I. ”, Transazioni della Royal Society di Edimburgo , vol. 16, n ° 4,1849, pag. 463–474 ( DOI 10.1017 / s0080456800022432 , leggi online )
- (Anderson, 1849), p. 124.
- (Fehling e l'inferno, 1890), p. 575.
- (Wolffenstein, 1922), p. 42.
- (De) Adolf Baeyer , “ Untersuchungen über die Basen der Pyridin- und Chinolinreihe. I. Ueber die Synthese des Picolins ” [“ Indagini sulle basi della serie piridina e chinolina. I. Sulla sintesi della picolina ”], Annalen der Chemie und Pharmacie , vol. 155, n . 3,1870, pag. 281–294 ( DOI 10.1002 / jlac.18701550304 , leggi online )
- James Dewar , “ Sui prodotti di ossidazione della picolina ”, Chemical News , vol. 23,27 gennaio 1871, pag. 38–41 ( leggi online ) Da pag. 40: "Se consideriamo la picolina come con ogni probabilità metilpiridina,..."
- W. Koerner , " Sintesi di una base isomerica con toluidina ", Giornale di Scienze Naturali ed Economiche (Journal of Natural Science and Economics (Palermo, Italy)) , vol. 5,1869, pag. 111-114 ( leggi online )
- (in) H. Weidel , " Studien über Verbindungen aus dem animalischen Theer " ["Sullo studio dei composti di catrame animale"], Berichte der Deutschen Chemischen Gesellschaft , vol. 12, n o 21879, pag. 1989–2012 ( DOI 10.1002 / cber.187901202207 , leggi online ) P. 2008: “Eine vollständige Trennung gelingt nur durch die Platindoppelsalze. Das des α-Picolins (wie ich es nennen will) ist schwerer löslich als jenes des β-Picolins. " (La separazione completa [i due isomeri] è possibile solo tramite i loro sali di sali doppi di platino. Questo [sale doppio] di α-picolina (chiamato come I) è meno solubile della β-picolina). P. 2011: "Es kann daher Baeyer's aus Acroleïnammoniak gewonnene Base vielleicht als das dritte, nach Koerner's Auffassungsweise mögliche γ-Picolin betrachtet werden." (Così, la base di Baeyer che è stata ottenuta dall'acroleinammoniak può forse essere considerata, secondo l'interpretazione di Körner, come la terza possibile [isomero], -picolina.)
- (Weidel, 1879), p. 1994.
- (Weidel, 1879), p. 2004.
- H Weidel , " Zur Kenntniss des Nicotins " ["[Contributo] alla nostra conoscenza della nicotina"], Annalen der Chemie und Pharmacie , vol. 165, n . 21873, pag. 328–349 ( DOI 10.1002 / jlac.18731650212 , leggi online )
-
Vedi:
- in (Weidel, 1879), pp. 2000-2001, Weidel mostra che la decarbossilazione dell'acido picolinico produce piridina;
- in (Weidel, 1873), p. 343, Weidel mostra che la decarbossilazione della niacina produce piridina;
- in (Weidel, 1879), p. 2000, Weidel descrive la picolina come piridina con un gruppo metile (CH 3 -), C 5 H 5 N --- CH 3 ;
- in (Weidel, 1879), p. 2008, Weidel descrive che il suo campione di picolina contiene almeno due isomeri di picolina: "... ein Gemisch von zwei Isomeren..." (... una miscela di due isomeri...).
- In (Weidel, 1879), p. 2011: “Die mitgetheilten Thatsachen reichen noch nicht aus, um endgültige theoretische Erklärungen namentlich der Isomerien, die offenbar in der relativen Stellung der CH 3 -, resp. COOH-Gruppe zum Stickstoff ihren Grund haben, zu geben. " (I fatti riportati non sono ancora sufficienti per fornire spiegazioni teoriche definitive, soprattutto sull'isomerismo, che è ovviamente dovuto alla posizione relativa di CH 3 - COOH rispettivamente. - rispetto all'azoto))
- (de) Zd. H. Skraup e A. Cobenzl , “ Über α– and β – Naphthochinolin ” [“On α– and β – naphthoquinoline”], Monatshefte für Chemie , vol. 4,1883, pag. 436–479 ( DOI 10.1007 / BF01517985 , S2CID 96180283 , leggi online ) Vedi illustrazione di Nicotinsaur (acido nicotinico o niacina) p. 455.
Vedi anche
- piridina
- Lutidina (dimetilpiridina)
- Collidina (trimetilpiridina)

