Paralisi sopranucleare progressiva
Paralisi sopranucleare progressiva - PSP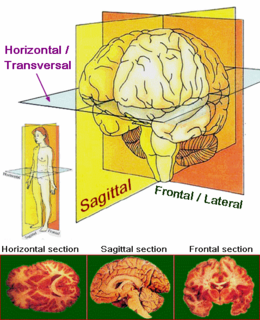 Principali piani anatomici e assi applicati alle sezioni del cervello.
Principali piani anatomici e assi applicati alle sezioni del cervello.
| Specialità | Neurologia |
|---|
| ICD - 10 | G23.1 |
|---|---|
| CIM - 9 | 333.0 |
| OMIM | 601104 |
| Malattie DB | 10723 |
| MedlinePlus | 000767 |
| eMedicine | 1151430 |
| eMedicine | neuro / 328 |
| Maglia | D013494 |
| Paziente del Regno Unito | Pro progressivo-paralisi sopranucleare |
La paralisi sopranucleare progressiva (PSP o malattia di Steele-Richardson-Olszewski , i nomi dei medici che la caratterizzarono nel 1963) è una malattia neurodegenerativa dovuta alla progressiva distruzione dei neuroni da varie regioni del cervello, lo striato , la formazione reticolata del tronco cerebrale , il luogo del Niger , i nuclei dei nervi cranici . Queste lesioni causano in particolare una difficoltà nell'esecuzione delle saccadi oculari verticali ( oftalmoplegia sopranucleare ), caratteristiche della PSP, ma influenzano gradualmente anche l' equilibrio , la vista , la deambulazione , la deglutizione , la parola e più in generale i movimenti effettuati sul piano sagittale . La PSP colpisce circa sei persone su 100.000, sia uomini che donne, senza essere in grado di identificare alcun fattore di rischio legato all'etnia, all'ambiente di vita o all'attività professionale. Alcuni dei sintomi della PSP sono simili a quelli della degenerazione frontotemporale , del morbo di Parkinson o dell'atrofia multisistemica, ma si distingue per il danno oculomotore. I meccanismi patologici della PSP rimangono poco conosciuti: a volte viene descritta come tauopatia perché la degenerazione neurofibrillare è associata ad un accumulo di proteina Tau nelle cellule nervose.
Scoperta
Questa condizione è stata descritta per la prima volta nel 1904, anche se ricerche di anteriorità evocano casi di PSP probabile, almeno dalla metà del XIX ° secolo. Questo è tuttavia che in seguito alle osservazioni di P r J. Clifford Richardson nel 1950 a Toronto, e dopo aver invitato il P r John Steele e P r Jerzy Olszewski (pl) a studiare i cambiamenti patologici nel sistema nervoso centrale, che PSP essere identificato come una malattia a sé stante daGiugno 1963. Con la pubblicazione nel 1964 del lavoro dei tre neurologi, la PSP sarà riconosciuta con il suo nome attuale, come una specifica entità nosologica, nota anche con il nome di "malattia di Richardson-Olszewski", "sindrome di Steele" negli Stati Uniti, e sotto il nome di "malattia di Steele-Richardson-Olszewski" in Europa.
La sindrome di Guam, identificata anche dal P r John Steele, è una forma particolare di PSP dell'isola di Guam nel Pacifico. È quindi anche una sindrome parkinsoniana atipica che spesso è l'associazione del morbo di Parkinson con la sclerosi laterale amiotrofica e la demenza.
Spiegazione del termine
Di solito una "paralisi" è una debolezza motoria o paralisi di una parte del corpo.
Il termine "sopranucleare" si riferisce alla natura del problema agli occhi in PSP. Sebbene alcuni pazienti con PSP descrivano il loro sintomo come "sfocato", il vero problema è l'incapacità di indirizzare correttamente gli occhi a causa della debolezza (o paralisi) nei muscoli che muovono i bulbi oculari. Questi muscoli sono controllati da cellule nervose che risiedono in gruppi, o "nuclei", vicino alla base del cervello, nel tronco cerebrale.
La maggior parte dei problemi che influenzano i movimenti oculari provengono da questi nuclei nel cervello, ma nella PSP il problema deriva dalle parti del cervello che controllano questi nuclei stessi. Queste zone di controllo "superiori" sono ciò a cui si riferisce il prefisso " supra " in "sopranucleare" (sopra i nuclei) .
Fisiopatologia
Le principali aree del cervello colpite dalla PSP sono:
- il tronco encefalico , in particolare la parte del mesencefalo dove risiede il movimento “sopranucleare” dell'occhio, così come i nuclei dopaminergici;
- i gangli della base , in particolare il nucleo subtalamico , la substantia nigra (o locus niger ) e il globus pallidus ;
- la corteccia cerebrale , in particolare l'area dei lobi frontali;
- il nucleo seghettato del cervelletto (il cervelletto rappresenta un buon 50% dei nostri neuroni) ;
- e il midollo spinale , in particolare l'area in cui vengono eseguiti alcuni controlli della vescica e dell'intestino.
Epidemiologia
La PSP è una malattia rara perché colpisce meno di una persona su 2.000, soglia al di sotto della quale, nell'Unione Europea, una malattia è definita rara. La prevalenza più segnalata per la PSP è di circa 6 pazienti ogni 100.000 persone. Questa cifra rimane solo un'indicazione fino ad oggi. È anche una malattia orfana nella misura in cui non è attualmente noto un trattamento efficace. La PSP è una malattia con una prognosi grave.
Colpisce decine di migliaia di persone negli Stati Uniti e in Europa (da 40.000 a 60.000, secondo le stime). Colpisce gli uomini un po 'più delle donne (differenza di circa il 2%). Si verifica principalmente nelle persone di età compresa tra i 55 ei 65 anni.
Diagnostico
Sintomi
I primi sintomi sono rallentamento intellettuale con ritenzione episodica della memoria , cambiamenti comportamentali come perdita di interesse ( svogliatezza ) o irritabilità. Questi disturbi comportamentali possono imitare uno stato depressivo. I pazienti si consultano più spesso per gravi disturbi dell'equilibrio, responsabili di cadute. Questi pazienti possono cadere più volte al giorno; cade all'indietro, a metà giro. I pazienti sono molto instabili e tendono a cadere sulla sedia. La perdita di equilibrio peggiora al punto da rendere difficile o addirittura impossibile camminare.
I disturbi della fluidità verbale e del linguaggio sono molteplici: balbuzie ( palilalia , ecolalia ), perseveranza verbale, rumore nasale e difficoltà nell'emettere frasi comprensibili.
Disturbo dell'attenzione: il paziente ha difficoltà a portare avanti una conversazione a lungo termine, cambiando bruscamente argomento senza accorgersene dopo pochi minuti. Questo periodo viene abbreviato per rendere impossibile la conversazione, con una concomitante evoluzione verso l' afasia .
Oltre ai disturbi dell'equilibrio e della mobilità, vengono aggiunti disturbi più insidiosi come le difficoltà visive. Questi problemi visivi derivano dall'incapacità di guidare gli occhi a causa di danni ai centri cerebrali che controllano i movimenti oculari. I disturbi della deglutizione si verificano più tardi, e possono portare a “false vie” alimentari, che a loro volta portano a complicazioni polmonari: l'asfissia per soffocamento è una frequente causa di morte alla fine del corso. Per mantenere una corretta alimentazione del paziente, senza sbagliare strada, può diventare indispensabile una gastrostomia , così come l'utilizzo di un aspiratore tracheale per catarro.
Essendo l'ordine di comparsa dei sintomi variabile da persona a persona e essendo i sintomi stessi comuni ad altre patologie, la diagnosi rimane difficile. La diagnosi può essere sospettata clinicamente di fronte a disturbi posturali, segni parkinsoniani assiali e disturbi oculomotori. L'esame clinico cercherà lentezza nello sguardo verso l'alto, rigidità cervicale, più in generale un deficit motorio sul piano sagittale, disturbi cognitivi subcorticali frontali e difficoltà a fermare movimenti motori ripetuti come sequenza di 3 applausi.
Il deficit motorio nel piano sagittale spiega le difficoltà oculari verticali, le cadute spontanee all'arresto per difetto di correzione della postura, la difficoltà a deglutire. Il deficit oculomotore induce anche cadute in avanti, non potendo più il paziente controllare di nascosto la presenza di ostacoli sul terreno sul suo percorso (adattamento dell'ambiente del paziente).
Tra i principali sintomi e segni clinici, dobbiamo ricordare:
- disturbi dell'equilibrio fino alla caduta (segno precoce) e più in particolare all'indietro,
- la magnetizzazione dello sguardo: perdita di mobilità dello sguardo e in particolare nel muovere gli occhi dall'alto verso il basso,
- cambiamenti nel comportamento: rallentamento della deambulazione, fluidità nelle parole, apatia, impulsività, aggressività, instabilità dell'attenzione e linguaggio monotono,
- comportamento di presa: difficoltà ad allentare la mano dagli oggetti tenuti,
- la presenza di una sindrome disesecutiva: perseveranza, disturbo del giudizio, difficoltà a risolvere i problemi.
Test aggiuntivi
La risonanza magnetica cerebrale può rivelare alcune anomalie caratteristiche: assottigliamento della parte superiore della protrusione (sagittale), spaziatura dei peduncoli cerebrali (sezione assiale), allargamento del 4 ° ventricolo (sezione assiale), atrofia frontale.
In generale, è l'esame neuropatologico a fare la diagnosi di PSP, a seconda della distribuzione topografica delle lesioni, la cui interpretazione può essere comune ad altre taupatie come DCB e certi FTD di tipo lobo.
Ad oggi sono state stabilite cinque varianti della PSP:
- PSP classica (la più frequente) e altre quattro atipiche:
- PSP di tipo parkinsoniano (PSP-P);
- PSP-acinesia pura con “congelamento” della deambulazione (PSP-PAGF);
- Sindrome PSP-corticobasale (PSP-CBS);
- PSP-afasia progressiva non fluente (PSP-PNFA).
Diagnosi differenziale
Le principali diagnosi differenziali sono:
- la malattia di Alzheimer (AD);
- il morbo di Parkinson (PD);
- la degenerazione corticobasale (DCB);
- la degenerazione Frontotemporale (DFT) o morbo di Pick ;
- l' atrofia del sistema multiplo (AMS).
La PSP può essere difficile da riconoscere almeno all'inizio della malattia perché i disturbi iniziali sono presenti anche in altre malattie neurodegenerative , come per le più note quelle del Parkinson e dell'Alzheimer , ma anche come quelle dell'AMS ( Atrophy Multi-Systematized ), o DCB ( Cortico-Basal Degeneration ) che è molto vicino alla PSP. Non molto tempo fa, nel caso del DCB, i medici esperti si sbagliavano più del 50% delle volte.
L'errore diagnostico resta comunque importante, in media più di tre anni, con forti disparità. Si ritiene che la PSP rappresenti almeno il 5% delle sindromi parkinsoniane, motivo per cui è importante, la seconda sindrome parkinsoniana dopo la malattia di Parkinson.
L' oftalmoplegia Supranucleare (stabilità della "magnetizzazione dello sguardo" e riduzione del campo particolarmente verticale) che i pazienti vengono raggiunti, rimane una delle prime caratteristiche visibili per la diagnosi. In effetti, la conseguenza della paralisi dei bulbi oculari è quella di causare cadute inspiegabili e all'indietro. D'altra parte, non c'è tremore parkinsoniano ei sintomi sono resistenti al trattamento con L-Dopa .
La PSP è una delle sindromi parkinsoniane di cui è noto il processo evolutivo ma non la causa esatta. Si distingue dalla malattia di Parkinson per un decorso più grave, con poca o nessuna risposta al trattamento. Le PSP, come la DCB, che le assomiglia molto, sono malattie a prognosi infausta, con progressione graduale, molto debilitanti e per le quali ad oggi possono essere curati solo i sintomi. Di cure palliative sono da aspettarsi.
Nelle sindromi parkinsoniane degenerative atipiche a volte denominate sindromi parkinsoniane più , che differiscono dalla malattia di Parkinson in particolare per la bassa, o addirittura l'assenza di reattività al trattamento dopaminergico derivante, tra l'altro, dalle lesioni postsinaptiche, si distingue quindi:
- atrofia multisistemica e demenza da corpi di Lewy nelle sinucleinopatie ;
- paralisi sopranucleare progressiva e degenerazione corticobasale nelle taupatie.
Genetica e fattori di rischio
La PSP non è ereditaria . Infatti, quando un membro della famiglia ha la PSP, ci sono meno dell'1% dei casi in cui altri membri della stessa famiglia mostrano sintomi di PSP. In confronto, per una malattia considerata anche non ereditaria: il 15% delle persone con Parkinson ha un parente affetto e almeno il 5% dei pazienti è riconosciuto come affetto da una forma di Parkinson legata a una mutazione in geni specifici.
Una variante del gene della proteina tau chiamato aplotipo H1, situato sul cromosoma 17, è stata collegata alla PSP . Quasi tutte le persone con PSP hanno ricevuto questa variante da ciascuno dei loro genitori, ma anche circa due terzi della popolazione generale. Pertanto, l'aplotipo H1 sembra essere necessario, ma non sufficiente, per generare PSP.
Sono in corso ricerche su altri geni (possibili predisposizioni genetiche ) , nonché su componenti ambientali tossiche nonché su altri contributori sospettati di intervenire nell'insorgenza della malattia.
Per la sindrome di Guam e le sindromi parkinsoniane atipiche delle Antille inclusa la Guadalupa, è stato dimostrato, per questi PSP, un rischio aggiuntivo di insorgenza di un fattore alimentare (consumo in particolare di soursop ). Inoltre, a Wattrelos è stata osservata un'epidemia di PSP, correlata a un significativo inquinamento da arsenico . I due hanno in comune il fatto di essere potenti inibitori mitocondriali. Pertanto, oltre alla tauopatia, la disfunzione mitocondriale sembra essere un fattore importante in questa malattia.
Trattamento
Per alcuni profili di PSP, e all'inizio della malattia, possono essere utilizzati trattamenti adattati al morbo di Parkinson ( dopamina , rivastigmina , ecc. ). Tuttavia, in caso di risultati, questi rimangono spesso deboli e sempre temporanei. D'altra parte, va ricordato che, per il paziente, viene preso qualsiasi guadagno preso.
Le cure attuali, nel tempo, sono quindi essenzialmente sintomatiche e cercano di combattere il disagio causato dalla malattia e dal suo decorso. In quanto tali, la famiglia e l'entourage del paziente sono essenziali, ma devono essere essi stessi sostenuti e aiutati a livello materiale e morale per l'attuazione delle cure palliative e del trattamento secondo l'evoluzione della malattia. La sedia a rotelle e le relative sistemazioni sono attrezzature abbastanza precoci in PSP.
Da allora il Parlamento europeo ha già adottato un regolamento sui farmaci orfani 15 dicembre 1999.
Infine, dopo aver ottenuto lo status di "farmaco orfano" dalla FDA e dall'EMEA ( le due agenzie farmaceutiche per gli Stati Uniti e l'Europa ), due farmaci, Davunetide e ZentylorTM , sono in fase di rilascio, sperimentazione di fase II per il controllo della PSP. Hanno ottenuto l'approvazione della FDA per una procedura di valutazione accelerata ai sensi delle nuove disposizioni in materia di biotecnologia .
Dall'inizio del 2013, abbiamo purtroppo saputo, per Davunetide in uno studio di fase III, che nessuno degli endpoint secondari o esplorativi mostrava segni di cambiamento. C'è da sperare che, nonostante tutto, questo fallimento contribuisca positivamente alla lotta contro questa malattia.
Prognosi
La malattia non è direttamente fatale, d'altra parte accorcia l'aspettativa di vita di chi ce l'ha. Dato l'errore diagnostico da un lato e l'età e lo stato di salute generale del paziente dall'altro, questa aspettativa di vita per un paziente con diagnosi di PSP raramente supera i 15 anni. D'altra parte, le medie in quest'area non sono significative perché non riflettono le forti disparità tra un paziente e l'altro. La media più accettata è di circa 7 anni. Le principali cause di riduzione dell'aspettativa di vita, o addirittura di mortalità, nei pazienti con PSP possono essere:
- cadute accidentali all'indietro, caratteristiche della malattia;
- infezioni delle vie respiratorie dovute a ripetute aspirazioni;
- esaurimento generale e prematuro del paziente, soprattutto se il paziente soffre di altre patologie ed è anziano.
Ricerca
Diagnostico
Esame neuropatologico post mortem / AnatomopatologiaCome per altre malattie neurodegenerative, rimane, fino ad oggi, l'unico esame che consente una diagnosi definitiva di paralisi sopranucleare progressiva. A questo proposito, i pazienti e le loro famiglie che donano il loro cervello stanno facendo notevoli progressi nella comprensione e nella lotta alla PSP e alle malattie neurodegenerative.
Sebbene sia stato stabilito che c'era anche un danno al sistema nervoso enterico nei pazienti con Parkinson, sembra esserci una correlazione tra danno al sistema nervoso centrale e danno al sistema nervoso enterico. Questo progresso è considerevole per lo screening e per lo sviluppo e la "messa a punto" dei farmaci attuali e futuri. Infatti il sistema nervoso centrale è accessibile solo dopo la morte dei pazienti. Non è il caso dei sistemi nervosi periferici come il sistema nervoso enterico, che ha il vantaggio di poter effettuare indagini in vivo mediante una semplice biopsia . La difficoltà della diagnosi verrebbe così aggirata.
Altri approcciIl progetto europeo NNIPPS, che ha coinvolto 800 pazienti, ha proposto nel 2001 di studiare le specificità cliniche, cognitive, neuro-radiologiche e istologiche della PSP. I risultati finali pubblicati nel 2011 hanno purtroppo confermato che le prove non avevano prodotto i risultati di efficacia attesi. Sono inoltre in corso ricerche sulla natura dei disturbi oculomotori e dell'equilibrio che sono caratteristici della condizione.
Le malattie DCB, PSP, DFT tra cui il morbo di Pick sono considerate taupatie (o taupatie), malattie dovute ad anomalie della proteina tau , proprio come il morbo di Alzheimer, meglio conosciuto per il numero di pazienti interessati.
Tuttavia, la classificazione delle patologie neurodegenerative è diventata più complicata dalla metà alla fine degli anni '90.
Con approcci molecolari e genetici, per le malattie neurodegenerative è apparsa una nuova classificazione e definizione, basata sulla natura dei costituenti delle lesioni neuropatologiche:
- Le tauopatie includono malattie in cui sono coinvolti i microtubuli proteici tau. Ciuffi o cespugli di proteina tau si formano, si accumulano e si diffondono, portando gradualmente alla morte neurale delle cellule contaminate. Le principali taupatie degenerative negli adulti sono il morbo di Alzheimer, la paralisi sopranucleare progressiva, la degenerazione cortico-basale e che sono paragonate anche alla malattia dei grani argirofili , al morbo di Pick e alle degenerazioni frontotemporali con sindrome parkinsoniana legate al cromosoma 17.
- Le sinucleinopatie hanno depositi anormali di alfa-sinucleina . Questa proteina presinaptica è una componente importante delle lesioni nella malattia di Parkinson e nelle demenze con corpi di Lewy, così come atrofie sistemiche multiple. Nelle inclusioni citoplasmatiche gliali di atrofia sistematizzata multipla, si osserva anche un accumulo di proteine alfa-sinucleina.
La proteina FKBP52 agisce come una sorta di proteina anti-Tau in quanto un'elevata presenza di FKBP52 impedirebbe l'accumulo di proteine Tau nei neuroni. La proteina FKBP52 è quindi allo studio, con una doppia sfida: consentire uno screening migliore misurando la quantità di proteina FKBP52 e sviluppare farmaci per bloccare lo sviluppo della patologia tau.
Tutti questi esperimenti verranno proseguiti al fine di ottenere risultati più ampi in grado di modellare processi terapeutici, in particolare basati su strategie mirate alla proteina Tau.
Nella ricerca applicata si stanno effettuando test su diverse molecole già note ma dosate in modo da poter costituire un trattamento contro la PSP. È il caso del litio (Stati Uniti), Q10 (Stati Uniti e Regno Unito), valproato di sodio (Francia), cloruro di metiltioninio , ecc. Ad oggi, anche per le molecole più promettenti nelle prime fasi di sperimentazione, questi farmaci non hanno fornito gli effetti terapeutici attesi.
Vanno inoltre menzionati i test sulla proteina sfingomielinasi neutra (N-SMasi) che, innescata da lesioni amiloide e DNF (dove è coinvolta la tau) , diverrebbe inoperante nel processo apoptotico di morte neuronale, una volta che questa proteina N-SMase inibito. Il risultato atteso sarebbe pari al capitale neuronale così preservato, in particolare in termini di memoria nel caso del morbo di Alzheimer.
Meccanismi
La proteina tau, una proteina fortemente coinvoltaLa codifica delle proteine obbedisce a complessi meccanismi biochimici e molecolari, appositamente per assumere le normali funzioni di vita o di morte ( apoptosi ) delle nostre cellule.
Negli anni '80, la degenerazione neurofibrillare era associata alla proteina tau che, a lungo trascurata dalla ricerca, sta ora suscitando rinnovato interesse.
La proteina tau, come tutte le altre proteine, è codificata dai nostri geni e il gene che codifica per la proteina tau si trova sul cromosoma 17 . Ogni essere umano produce la proteina tau che normalmente non è patogena e che, anche quando può diventarlo con l'età, rimane atossica perché non si espande nel sistema nervoso. I meccanismi che governano il passaggio dalla situazione non patogena da proteina tau a patogeno, quindi da patogeno a tossico, rimangono inspiegabili.
Il decorso della malattia corrisponde a quello della tau nel cervello. La patologia tau ha una firma biochimica e morfologica della degenerazione neurofibrillare. D'altra parte, non ci si può aspettare una relazione molto precisa tra una regione interessata e uno specifico segno cognitivo, perché sono coinvolti altri fattori aggravanti.
Tuttavia, va ricordato che la patologia tau ha un significato, in quanto la patologia va nella direzione dei segni clinici. Ad esempio per l'Alzheimer: perdita di memoria ( ippocampo affetto) poi gradualmente afasia ( corteccia temporale mediana e superiore affetta come nella demenza semantica , quindi anteriore anteriore e area di Broca che sono diverse aree del linguaggio), aprassia ( corteccia frontale interessata) agnosia ( lobo parietale) , lobo occipitale ). Il coinvolgimento frontale può anche causare disturbi comportamentali.
Più la patologia tau avanza nella corteccia, più variabile diventa il percorso, a seconda della vulnerabilità individuale. La variazione nel coinvolgimento delle regioni della corteccia associativa poi primaria causa marcate variazioni cliniche interindividuali. Ecco perché ogni malattia neurodegenerativa ha un profilo generale e statistico abbastanza preciso e costante, ma ogni caso ha la sua specificità. Questo profilo di sviluppo può essere rappresentato, ad esempio per la malattia di Alzheimer, in 10 stadi caratteristici degli attacchi.
Organizzazione di cure, cure e ricerca in Francia
Da Maggio 2007, nell'ambito del primo Piano Nazionale Malattie Rare, in collaborazione con l'associazione PSP Francia, è stato etichettato un centro di riferimento per la paralisi sopranucleare progressiva presso l' ospedale Salpétrière di Parigi.
Da Marzo 2009, la rete nazionale di centri di riferimento e di competenza per PSP mira a fornire ulteriori competenze nel supporto, nella cura e nella ricerca. L'associazione PSP France (per PSP e DCB), cui ha aderito all'inizio del 2010 l'associazione France-DFT (per DFT), sono ad oggi le uniche due associazioni di pazienti presenti all'interno di questa rete per demenze rare, nel significato medico del termine e non psichiatrico (classificazione nosologica) .
Da 28 febbraio 2011, è stato rinnovato il PNMR (Piano Nazionale Malattie Rare) con un budget di 180 milioni di euro.
La ricerca, compreso il centro NeuroSpin , mira a comprendere meglio i meccanismi di degenerazione neuronale, a riconoscerli e prevenirli meglio; per rallentare meglio la progressione di questo tipo di malattia, o addirittura curarla.
Personalità con la malattia
- Peter Sarstedt (1941-2017), cantante inglese.
- Abdus Salam (1926-1996), fisico pakistano vincitore del Premio Nobel per la Fisica nel 1979 con Sheldon Glashow e Steven Weinberg .
Note e riferimenti
- Charles Dickens (1857), letteratura e PSP
- (in) Richardson JC Steele J, Olszewski J, " oftalmoplegia sopranucleare, paralisi pseudobulbare, distonia nucale e demenza. Un rapporto clinico su otto casi di "degenerazione del sistema eterogeneo" " , Transactions of the American Neurological Association , vol. 88, 1963, p. 25-9 ( PMID 14272249 )
- (in) I. Litvan et al. "Accuratezza della diagnosi clinica di degenerazione corticobasale: uno studio clinicopatologico" Neurology 1997: 48: 119-25.
- (in) Samii A Nutt JG, BR Ransom, " Parkinson's disease " , Lancet , vol. 363, n o 9423,Maggio 2004, p. 1783–93 ( PMID 15172778 , DOI 10.1016 / S0140-6736 (04) 16305-8 )
- (in) Lesage S Brice A, " Morbo di Parkinson: dalle forme monogeniche ai fattori di suscettibilità genetica " , Hum. Mol. Scopa. , vol. 18, n o R1,aprile 2009, R48–59 ( PMID 19297401 , DOI 10.1093 / hmg / ddp012 )
- [PDF] Farmaco orfano
- Lo studio multinazionale Davunetide , che coinvolge 300 pazienti, è in corso nelle principali istituzioni mediche di Stati Uniti, Australia, Germania, Francia, Canada e Regno Unito. [1]
- [PDF] Procedura accelerata
- [PDF] File delle biotecnologie
- Sito esplicativo per la donazione del cervello
- [PDF] PLoS ONE, settembre 2010 | Volume 5 | Edizione 9 | e12728
- [PDF] PLoS ONE, agosto 2011 | Volume 6 | Edizione 8 | e22293
- [PDF] cpINSERM 26 gennaio 2010
- [PDF] Strategia mirata alla proteina Tau , Gestione della malattia di Alzheimer: dati attuali e in fase di sviluppo - Estratti di marzo 2011
- [PDF] Nuovo obiettivo contro l'Alzheimer
- Annals of the Institut Pasteur / News - Volume 11, Issue 2, 6 April 2000, Pages 25-45.
- (in) Delacourte A David JP, Sergeant N et al. "Il percorso biochimico della degenerazione neurofibrillare nell'invecchiamento e nella malattia di Alzheimer" Neurology 1999; 52: 1158-65.
- (in) A Delacourte A e L Condensation "Proteine Tau normali e patologiche come fattori per l'assemblaggio dei microtubuli" Int Rev Cytol. 1997; 171: 167-224.
- [PDF] Piano nazionale per le malattie rare 2005-2008
- Rete nazionale di centri di riferimento e di competenza per PSP
- Piano nazionale per le malattie rare 2010-2014
- [PDF] Neurospin 24 novembre 2006
- "Il cantautore Peter Sarstaedt muore a 75 anni" , BBC , 8 gennaio 2017
Riferimenti esterni
- Il cervello a tutti i livelli : un blog canadese da leggere.
- Rete di centri di riferimento e di competenza per le demenze rare
- ORPHANET, il portale delle malattie rare e dei farmaci orfani
- PSP 39 - Sindromi di Parkinson Parkinson
- Fondazione PSP - Stati Uniti
- Associazione per la paralisi sopranucleare progressiva - PSP Francia
Galleria di immagini
-
Mesencefalo e retroencefalo (vista postero-laterale).
-
Base del cervello.
-
Dall'occhio alla corteccia visiva .
-
Schema delle vie ottiche tra le due retine e la corteccia visiva.