Trimetilsilile
Per il tetrametilsilano, che è anche abbreviato in TMS, vedere tetrametilsilano .Il gruppo trimetilsilile o TMS è un gruppo funzionale silile in chimica organica . Consiste di tre gruppi metili legati a un atomo di silicio [Si (CH 3 ) 3 ], che è legato al resto della molecola . Questo gruppo è caratterizzato da una buona inerzia chimica e un grande volume molecolare che lo rende un gruppo molto utile per molte applicazioni.
Il gruppo trimetilsilile legato ad un metile forma tetrametilsilano che ha anche l' acronimo TMS . I composti con uno o più gruppi trimetilsililici non si trovano in natura.
A volte i chimici usano un reagente trimetilsililante come trimetilsilil cloruro o bis (trimetilsilil) acetammide per formare derivati più volatili composti involatili, come alcuni alcoli , fenoli o acidi carbossilici , sostituendo l'atomo di idrogeno del gruppo idrossile di questi composti con un gruppo trimetilsilile. Si formano così [-O-Si (CH 3 ) 3 ] gruppi trimetilsilossi. I gruppi trimetilsililici innestati su una molecola tendono a renderla più volatile, rendendola così più lavorabile per l'analisi mediante gascromatografia o spettrometria di massa . Un esempio di tale trimetilsililazione è quello del brassicasterolo . Tali derivazioni vengono solitamente effettuate in piccole quantità in un'apposita fiala.
Molto spesso, il gruppo trimetilsilile viene utilizzato come gruppo protettivo . Quando sono attaccati a determinati gruppi funzionali di una molecola che deve reagire, i gruppi trimetilsilile vengono usati temporaneamente per proteggere questi gruppi durante una sintesi o una reazione chimica.
In cromatografia , la sostituzione dei gruppi silanolici (SiOH) legati alla fase stazionaria con trimetilsilili è chiamata “ end-capping ”.
In uno spettro 1 H NMR , i segnali degli atomi di idrogeno nei gruppi trimetilsilile del composto hanno spesso uno spostamento chimico vicino al picco di riferimento del tetrametilsilano a 0 ppm . Inoltre, composti come il silicone per alte temperature del tipo a grasso per rubinetti, che in realtà sono polisilossani , hanno comunemente gli spostamenti chimici NMR dei loro gruppi metilici (legati ad atomi di silicio) vicino al picco dello standard. Tetrametilsilano, ad esempio 0,07 ppm in CDCl 3 .
Infine, molecole molto reattive possono essere isolate avvolgendole con grossi gruppi trimetilsililici. Questo cosiddetto effetto corsetto può essere osservato nei tetraedri .
Gruppo super silyle
Relativamente al gruppo trimetilsilile, esiste quello che viene chiamato il gruppo super silile di cui esistono due varietà:
- da un lato, il gruppo tri (trimetilsilile) silile che consiste di tre gruppi trimetilsililici legati allo stesso atomo di silicio (TTMSS o TMS 3 Si)
- e dall'altra al gruppo tri (t-butil) silile che consiste di tre gruppi terz-butilici legati allo stesso atomo di silicio.
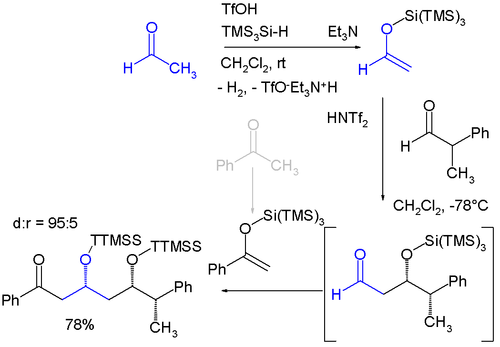
Il gruppo TTMSS stato proposto da Hans Bock nel 1993. Oltre alla sua grande dimensione maggiore rispetto al gruppo TIPS (triisopropylsilyl), l'altra applicazione legata al suo volume è il suo uso come sostituente temporanea per la promozione asimmetrica induzione. Di cui un esempio è la sintesi enantioselettiva del monotopo che coinvolge due aggiunte aldoliche Mukaiyama sequenziali:
Appunti
- ( fr ) Questo articolo è parzialmente o interamente tratto dall'articolo di Wikipedia in inglese intitolato " Trimethylsilyl " ( vedere l'elenco degli autori ) .
- Spostamenti chimici NMR di solventi di laboratorio comuni come tracce di impurità , Gottlieb, HE; Kotlyar, V .; Nudelman, A .; J. Org. Chem., 1997, vol. 62 (21), pagg. 7512-7515. DOI : 10.1021 / jo971176v .
- Gruppo "Super Silyl" per reazioni sequenziali diastereoselettive: accesso all'architettura chirale complessa in un vaso , Matthew B. Boxer e Hisashi Yamamoto, J. Am. Chem. Soc. , 2007, vol. 129 (10), pagg. 2762 - 2763 DOI : 10.1021 / ja0693542 .
- Tris (trimetilsilile) aldeide governata dalla silile Reazione a cascata Cross-Aldol , Boxer, MB; Yamamoto, H .; J. Am. Chem. Soc. , 2006, vol. 128 (1), pagg. 48-49. DOI : 10.1021 / ja054725k .
- I materiali di partenza sono acetaldeide e benzofenone, entrambi convertiti in silicio enol etere per reazione con tris (trimetilsilil) silano e acido trifilico e rimozione dell'idrogeno. La reazione aldolica è catalizzata dalla bis- (trifluorometano) -sulfonimmide ( bistriflimide (en) ).